题目内容
【题目】某温度时,在2 L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。
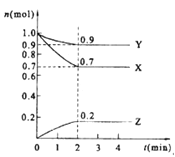
(1)由图中所给数据进行分析,该反应的化学方程式为 ;
(2)反应从开始至2分钟,用Z的浓度变化 表示的平均反应速率为v(Z)= ;
(3)2min反应达平衡容器内混合气体的平均相对分子质量比起始时 (填增大、减小或不变);混合气体密度比起始时 (填增大、减小或不变)。
(4)将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X) =" n" (Y) =" n" (Z),则原混合气体中a : b = 。
(5)下列措施能加快反应速率的是 。
A.恒压时充入He
B.恒容时充入He
C.恒容时充入X
D.及时分离出Z
E.升高温度
F.选择高效的催化剂
(6)下列说法正确的是 。
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关 D.化学反应的限度是不可能改变的
E. 增大Y的浓度,正反应速率加快,逆反应速率减慢
【答案】(1)3X+Y![]() 2Z (2)0.05mol·L-1·min-1 (3)增大 不变
2Z (2)0.05mol·L-1·min-1 (3)增大 不变
(4)5:3 (5)CEF (6)AC
【解析】试题分析:(1) 由图像可知,X、Y随着时间的推移物质的量不断减少,X、Y为反应物,Z随着时间的推移物质的量不断增加,Z为生成物。平衡时由各物质转化的物质的量:X为0.3 mol,Y为0.1mol,Z为0.2mol可知化学方程式中各物质的化学计量数之比为3∶1∶2,则化学方程式为3X+Y![]() 2Z。
2Z。
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=0.2mol÷(2min×2L)=0.05mol·L-1·min-1 。
(3)根据M=m÷n,在恒容、密闭容器中,混合气体的质量不变,随着反应的进行n值变小,则2min反应达平衡容器内混合气体的平均相对分子质量比起始时增大。由于反应前气体的质量和容器容积均不变,则混合气体密度不变。
(4)根据上述分析可知
3X+Y![]() 2Z
2Z
起始量(mol) a b 0
变化量(mol) 3n n 2n
平衡量(mol) a-3n b-n 2n
根据题意:b-n=2n,b=3n,a-3n=2n,a=5n,解得a:b=5:3。
(5)A.恒压时充入He,导致气体体积增大,各物质的浓度降低,化学反应速率减慢,B.恒容时充入He,各物质的浓度不变,化学反应速率不变,C.恒容时充入X,导致反应物浓度增大,化学反应速率加快,D.及时分离出Z,导致生成物浓度降低,化学反应速率减慢;E.升高温度能加快化学反应速率,F.选择高效的催化剂能加快化学反应速率,答案选CEF。
(6)A.任何化学反应都有热效应,升高温度,平衡发生移动,所以升温能改变化学反应限度,A正确;B.升高温度,能加快正逆反应速率,只是增加的幅度不同,B错误;C.化学反应的限度与时间长短无关,C正确;D.改变外界条件,例如升高温度,平衡发生移动,所以化学反应的限度是可以改变的,D错误;E.增大Y的浓度,正反应速率加快,逆反应速率也加快,E错误;答案选AC。



