题目内容
| 短周期元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6,-2 | -2 |
A.由以上分析可知L为Mg,Q为Be,为同主族元素,故A错误;
B.T的液态氢化物可为H2O、H2O2两种,其中H2O2既含有极性键又含有非极性键,故B错误;
C.非金属性T(O)>R(S),元素的非金属性越强,对应的氢化物越稳定,故C正确;
D.M形成的氯化物为AlCl3,为共价化合物,故D错误.
故选C.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案(12分)为比较温室效应气体对全球增温现象的影响,科学家以CO2为相对标准,引入了“温室效应指数”的概念(如下表)。
回答下列问题:
⑴6种气体中,温室效应指数最大的物质属于 ▲ (选填“极性分子”或“非极性分子”)。
⑵在水分子中,O原子上的价层电子对数为 ▲ 。
⑶N2O4分子结构式为,分子为平面结构。N2O4分子中N原子的杂化方式为 ▲ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头 ▲ 。
⑷O3具有吸收紫外光的功能。
①根据等电子原理,判断O3分子的空间构型为 ▲ 。
②紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: ▲ 。
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
(12分)为比较温室效应气体对全球增温现象的影响,科学家以CO2为相对标准,引入了“温室效应指数”的概念(如下表)。

回答下列问题:
⑴6种气体中,温室效应指数最大的物质属于 ▲ (选填“极性分子”或“非极性分子”)。
⑵在水分子中,O原子上的价层电子对数为 ▲ 。
⑶N2O4分子结构式为 ,分子为平面结构。N2O4分子中N原子的杂化方式为 ▲ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头 ▲ 。
,分子为平面结构。N2O4分子中N原子的杂化方式为 ▲ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头 ▲ 。
⑷O3具有吸收紫外光的功能。
①根据等电子原理,判断O3分子的空间构型为 ▲ 。
②紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: ▲ 。
|
共价键 |
C-C |
C-N |
C-S |
|
键能/ kJ·mol-1 |
347 |
305 |
259 |
(12分)为比较温室效应气体对全球增温现象的影响,科学家以CO2为相对标准,引入了“温室效应指数”的概念(如下表)。
| 物质 | 大气中的含量 (体积百分比) | 温室效应 指数 |
| CO2 | 0.03 | 1 |
| H2O | 1 | 0.1 |
| CH4 | 2×10-4 | 30 |
| N2O4 | 3×10-5 | 160 |
| O3 | 4×10-6 | 2000 |
| CCl2F2 | 4.8×10-8 | 25000 |
回答下列问题:
⑴6种气体中,温室效应指数最大的物质属于 ▲ (选填“极性分子”或“非极性分子”)。
⑵在水分子中,O原子上的价层电子对数为 ▲ 。
⑶N2O4分子结构式为![]() ,分子为平面结构。N2O4分子中N原子的杂化方式为 ▲ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头 ▲ 。
,分子为平面结构。N2O4分子中N原子的杂化方式为 ▲ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头 ▲ 。
⑷O3具有吸收紫外光的功能。
①根据等电子原理,判断O3分子的空间构型为 ▲ 。
②紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因: ▲ 。
| 共价键 | C-C | C-N | C-S |
| 键能/ kJ·mol-1 | 347 | 305 | 259 |
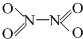 ,分子为平面结构.N2O4分子中N原子的杂化方式为
,分子为平面结构.N2O4分子中N原子的杂化方式为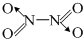
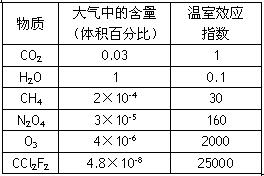
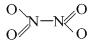 ,分子为平面结构。N2O4分子中N原子的杂化方式为 ▲ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头 ▲ 。
,分子为平面结构。N2O4分子中N原子的杂化方式为 ▲ ,在N2O4分子的结构式上,将你认为是配位键的共价键上加上箭头 ▲ 。