题目内容
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒 气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ/mol,ΔS=-145 J/(mol·K).
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为________.
| A.加催化剂同时升高温度 |
B.加催化剂同时增大压强 |
| C.升高温度同时充入N2 |
| D.降低温度同时增大压强 |
 平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).
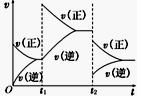
平均相对分子质量________,若升高温度,则该反应的平衡常数________(均填“增大”、“减小”或“不变”).(3)在如图中画出在某时刻条件改变后的图象(其他条件不变).t1:增大NO的浓度 t2:降低温度
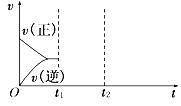
(4)判断该条件下反应能否自发.
(10分)(1)B (2)增大 减小
(3) 
(4)ΔG=ΔH-T·ΔS
=-113 kJ/mol+298 K×145×10-3 kJ/(mol·K)
=-69.79 kJ/mol<0故反应能自发进行.
解析

练习册系列答案
相关题目
 汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)?N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)?N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K). 汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).