题目内容
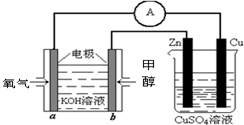
 (2012?上饶一模)乙醇燃料电池中采用磺酸类质子溶剂,电池总反应为:C2H5OH+3O2=2CO2+3H2O下列说法错误的是( )
(2012?上饶一模)乙醇燃料电池中采用磺酸类质子溶剂,电池总反应为:C2H5OH+3O2=2CO2+3H2O下列说法错误的是( )分析:燃料电池中,燃料失去电子发生氧化反应,所以a极是负极,则b极是正极,正极上氧化剂得电子发生还原反应;燃料电池放电时,电子从负极沿外电路流向正极,则电流从正极沿外电路流向负极;电解质溶液中带正电荷的微粒向正极移动,据此分析解答.
解答:解:A、该燃料电池放电时,带正电荷的微粒向正极移动,所以质子向正极移动,故A正确.
B、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,所以该燃料电池放电时,电流从正极b沿导线流向负极a,故B正确.
C、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,负极上燃料失去电子发生氧化反应,所以电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,故C错误.
D、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,正极上氧气得电子和氢离子反应生成水,所以电极反应式为4H++O2+4e-=2H2O,故D正确.
故选C.
B、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,所以该燃料电池放电时,电流从正极b沿导线流向负极a,故B正确.
C、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,负极上燃料失去电子发生氧化反应,所以电极反应式为C2H5OH+3H2O-12e-=2CO2+12H+,故C错误.
D、燃料电池中,投放燃料的电极是负极,投放氧化剂的电极是正极,正极上氧气得电子和氢离子反应生成水,所以电极反应式为4H++O2+4e-=2H2O,故D正确.
故选C.
点评:本题考查了原电池原理,明确正负极的判断方法、电极反应式的书写即可分析解答本题,难度不大.

练习册系列答案
相关题目



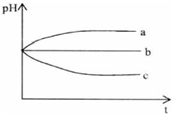 (2012?上饶一模)将pH相同的三种酸性溶液露置于空气中一段时间后,溶液的pH随时间的变化情况如图所示:则a、b、c三种溶液分别可能为( )
(2012?上饶一模)将pH相同的三种酸性溶液露置于空气中一段时间后,溶液的pH随时间的变化情况如图所示:则a、b、c三种溶液分别可能为( )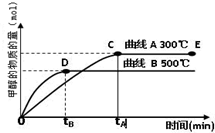 (2012?上饶一模)能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.
(2012?上饶一模)能源问题是人类社会面临的重大课题,日本大地震引起的核泄漏事故引起了人们对核能源的恐慌.而甲醇是未来重要的绿色能源之一.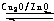 CH3OH(g).甲醇的物质的量与反应温度的关系如图所示:
CH3OH(g).甲醇的物质的量与反应温度的关系如图所示: