题目内容
(14分) 能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)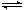 CH3OH(g)+H2O(g)ΔH1 反应II:CO(g)+2H2(g)
CH3OH(g)+H2O(g)ΔH1 反应II:CO(g)+2H2(g)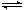 CH3OH(g) ΔH2
CH3OH(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”),
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)的变化
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
Ⅱ.若容器容积不变,下列措施可增加甲醇产率的是 ,
A.升高温度 B.将CH3OH(g)从体系中分离 C.使用合适的催化剂 D.充入He,使体系总压强增大 E.按原比例再充入 CO和 H2
Ⅲ.某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)="0.2" mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择);

(2)某实验小组依据甲醇燃烧的反应原理,设计如上图所示的原电池装置。
①该电池工作时,OH-向_______极移动(填“正”或“负”),
②该电池负极的电极反应为 。
考查绿色化学的思想、外界条件对平衡的影响以及电化学的应用等。
(1)①Ⅱ ② I.< Ⅱ.BE Ⅲ.80% 250℃(2)① 负
②CH3OH +8OH-— 6e- = CO32- + 6H2O
解析

 步步高达标卷系列答案
步步高达标卷系列答案(14分) 能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH1 反应II:CO(g)+2H2(g)
CH3OH(g) ΔH2
① 上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”),
② 下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)的变化
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
I.由表中数据判断ΔH2 0(填“>”、“<”或“=”),
Ⅱ.若容器容积不变,下列措施可增加甲醇产率的是 ,
A.升高温度 B.将CH3OH(g)从体系中分离 C.使用合适的催化剂 D.充入He,使体系总压强增大 E.按原比例再充入 CO和 H2
Ⅲ.某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择);
(2)某实验小组依据甲醇燃烧的反应原理,设计如上图所示的原电池装置。
① 该电池工作时,OH-向_______极移动(填“正”或“负”),
② 该电池负极的电极反应为 。
(14分) 能源短缺是人类面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)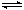 CH3OH(g)+H2O(g)ΔH1 反应II:CO(g)+2H2(g)
CH3OH(g)+H2O(g)ΔH1 反应II:CO(g)+2H2(g)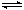 CH3OH(g)
ΔH2
CH3OH(g)
ΔH2
① 上述反应符合“原子经济”原则的是 (填“Ⅰ”或“Ⅱ”),
② 下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)的变化
|
温度 |
250℃ |
300℃ |
350℃ |
|
K |
2.041 |
0.270 |
0.012 |
I.由表中数据判断ΔH2 0(填“>”、“<”或“=”),
Ⅱ.若容器容积不变,下列措施可增加甲醇产率的是 ,
A.升高温度 B.将CH3OH(g)从体系中分离 C.使用合适的催化剂 D.充入He,使体系总压强增大 E.按原比例再充入 CO和 H2
Ⅲ.某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为 ,此时的温度为 (从上表中选择);
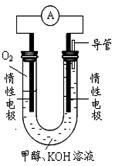
(2)某实验小组依据甲醇燃烧的反应原理,设计如上图所示的原电池装置。
① 该电池工作时,OH-向_______极移动(填“正”或“负”),
② 该电池负极的电极反应为 。