题目内容
下列离子方程式的书写与所给条件相符的是
| A.将4 molCl2通入到含有4 mol FeBr2的溶液中:2Cl2+2Fe2++2Br-= 4Cl-+Br2+2Fe3+ |
| B.已知亚硫酸(H2SO3)的第二级电离常数K2比偏铝酸(HAlO2)的电离常数K要大,则将少量的SO2气体通入到偏铝酸钠溶液中发生的离子反应是:AlO2-+ SO2+2 H2O =Al(OH)3↓+HSO3- |
| C.稀氨水溶液吸收了少量二氧化碳气体: NH3 ·H2O + CO2 = NH4+ + HCO3- |
| D.在明矾溶液中加入氢氧化钡溶液至沉淀质量达到最大时发生的离子反应是: 2Al3+ +3SO42-+3Ba2++6OH-= 3BaSO4↓+2 Al(OH)3↓ |
A
试题分析:A.根据电子守恒,将4 molCl2共得到8mol电子,先和二价铁离子反应,4 mol Fe2+得到4mol电子,还有4molBr-得到电子生成了2molBr2分子,FeBr2的溶液中:2Cl2+2Fe2++2Br-= 4Cl-+Br2+2Fe3+,故正确;B.亚硫酸(H2SO3)的二级电离常数K2比偏铝酸(HAlO2)要大,说明酸性:亚硫酸氢根离子>偏铝酸,则亚硫酸氢根离子也能和偏铝酸钠溶液,所以将少量的SO2气体通入到偏铝酸钠溶液中发生的反应为2AlO2-+SO2+3H2O=2Al(OH)3↓+SO32-,不符合强酸制弱酸的原则,故B错误。C.稀氨水溶液吸收了少量二氧化碳气体应该生成碳酸铵,错误;D.在明矾溶液中加入氢氧化钡溶液至沉淀质量达到最大时只要保证两个物质的量之比是2:3时可达到沉淀量最大,即发生的离子反应是: 3Ba2+ + 3SO42- +2Al3+ + 6OH- ="==2" Al(OH)3↓+3BaSO4

练习册系列答案
相关题目
 Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
Cu(HDz)2+2H+,再加入CCl4,Cu(HDz)2就很容易被萃取到CCl4中。
 )必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H
)必须转换成汞离子(Hg2+)才能用双硫腙络合。某工厂污水中含有较多的氯化亚汞(Hg2Cl2),加入二硫酸钾(K2S2O8)可氧化H NH3↑+H2O
NH3↑+H2O Fe3++3H2O
Fe3++3H2O H2↑+Cl2↑ +2OH—
H2↑+Cl2↑ +2OH— CO32— +H3O+
CO32— +H3O+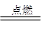 2H2O
2H2O  H3O++S2-
H3O++S2-