题目内容
下列各组物质中,化学键的类型相同的是
| A.CaCl2和Na2S | B.Na2O和Na2O2 | C.N2和Ne | D.HCl和NaOH |
A
解析试题分析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键。如果是同一种非金属之间则形成非极性键,不同种非金属元素之间形成极性键,据此可以判断。A、CaCl2和Na2S中均含有离子键,A正确;B、氧化钠中含有离子键,过氧化钠中含有离子键和非极性键,B不正确;C、氮气中只有非极性键,Ne分子中没有化学键,C不正确;D、氯化氢中含有极性键,氢氧化钠中含有离子键和极性键,D不正确,答案选A。
考点:考查化学键的判断

练习册系列答案
相关题目
硼及其化合物在催化剂制造、储氢材料、燃料电池等方面应用广泛。Li3BN2是一种价格低廉且性能优良的储氢材料,其储氢与放氢原理为Li3BN2+4H2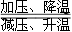 Li3BN2H8。下列有关说法正确的是
Li3BN2H8。下列有关说法正确的是
| A.B的原子半径小于N的原子半径 |
| B.H2的结构式为H—H |
| C.放氢过程为化合反应 |
| D.储氢过程没有能量变化 |
下列选项的说法中正确的是
| A.分子的结构是由键角决定的 |
| B.共价键的键能越大,共价键越牢固 |
| C.CF4、CCl4、CBr4、CI4中C—X键的键长、键角均相等 |
| D.H2O分子中的两个O—H键的键角为180° |
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是
| A.SO2和SiO2 | B.CCl4和KCl | C.NaCl和HCl | D.CO2和H2O |
2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N-N键的键能为160kJ/mol(N2的键能为942kJ/mol),晶体片段结构如图所示。又发现从N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是:
| A.该晶体中含有非极性共价键 |
| B.含N5+离子的化合物中既有离子键又有共价键 |
| C.高聚氮与N2、N3、N5、N5+、N60互为同素异形体 |
| D.这种固体的可能潜在应用是烈性炸药或高能材料 |
下列说法中错误的是( )
| A.当中心原子的配位数为6时,配合单元常呈八面体空间结构 |
| B.[Ag(NH3)2]+中Ag+空的5S轨道和5P轨道以sp杂化成键 |
| C.配位数为4的配合物均为正四面体结构 |
| D.已知[Cu(NH3)2]2+的中心原子采用sp杂化,则它们的空间构型为直线型 |
下列说法中正确的是
| A.离子化合物中可以含有共价键,但共价化合物中一定不含离子键 |
| B.含有共价键的物质一定是共价化合物 |
| C.分子中一定含有化学键 |
| D.含有金属元素的离子一定是阳离子 |
下列表示离子化合物形成过程的电子式正确的是( )
A. |
B.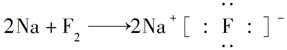 |
C.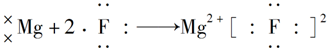 |
D.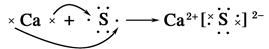 |
