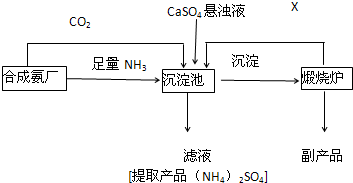
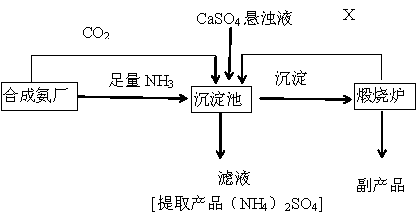
题目内容
某反应池中,发生“生物硝化过程”,利用O2将NH4+氧化成NO3-,如果不考虑过程中硝化细菌的增殖,其净反应如下式所示:
______+______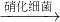 ______+______+______
______+______+______
完成上述反应的离子方程式并配平,将系数填入方框中,并标出电子的转移方向和数目.
(1)反应中,还原剂是______,被还原的元素是______.
(2)将铵态氮中的lmg氮转化成硝酸根中的氮,需氧气______mg.(精确到0.01)
(3)取100mL完全反应以后的溶液,加入19.2g铜粉及一定量的稀硫酸,恰好完全反应(假设还原产物全部是NO气体),则原溶液中NH4+的浓度为______mol/L.(假设反应前后溶液的体积不变)
解:由信息可知,O2将NH4+氧化为NO3-,根据电荷守恒可知,还生成H+,反应中NH4+→NO3-,N元素化合价由-3价升高为+5价,化合价总共升高8价,O2→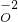 ,O元素化合价由0价降低为-2价,化合价总共降低4价,根据化合价升降相等可知,NH4+系数为1,O2系数为2,根据N元素是可知NO3-系数为1,根据电荷守恒可知H+系数为2,根据元素守恒可知还生成H2O,其系数为1,所以离子方程式为NH4++2O2=NO3-+2H++H2O.
,O元素化合价由0价降低为-2价,化合价总共降低4价,根据化合价升降相等可知,NH4+系数为1,O2系数为2,根据N元素是可知NO3-系数为1,根据电荷守恒可知H+系数为2,根据元素守恒可知还生成H2O,其系数为1,所以离子方程式为NH4++2O2=NO3-+2H++H2O.
故答案为:1NH4+、2O2;1NO3-、2H+、1H2O;
(1)在氧化还原反应中,化合价升高的元素被氧化发生氧化反应,元素化合价降低的元素被还原,该反应中反应中NH4+→NO3-,N元素化合价由-3价升高为+5价,NH4+为还原剂,O2→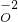 ,O元素化合价由0价降低为-2价,被还原的元素是O2中的O,电子由氮元素转移给氧元素,转移8个电子,
,O元素化合价由0价降低为-2价,被还原的元素是O2中的O,电子由氮元素转移给氧元素,转移8个电子,
故答案为:NH4+;O2中的O; ;
;
(2)令需要氧气的质量为x,则:
NH4++2O2=NO3-+2H++H2O.
18g 64g
1mg× x
x
所以x= ×1mg×
×1mg× =4.57mg
=4.57mg
故答案为:4.57;
(3)反应中NO3-→NO,N元素化合价由+5价降低为+2价,Cu→Cu2+,Cu元素化合价由0价升高为+2价,根据电子转移守恒有2n(Cu)=3n(NO3-)= ×2=0.6mol,所以n((NO3-)=0.2mol,根据N元素守恒有n(NH4+)=n(NO3-)=0.2mol,所以原溶液中NH4+的浓度为
×2=0.6mol,所以n((NO3-)=0.2mol,根据N元素守恒有n(NH4+)=n(NO3-)=0.2mol,所以原溶液中NH4+的浓度为 =2mol/L.
=2mol/L.
故答案为:2;
分析:由信息可知,O2将NH4+氧化为NO3-,根据电荷守恒可知,还生成H+,反应中NH4+→NO3-,N元素化合价由-3价升高为+5价,化合价总共升高8价,O2→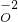 ,O元素化合价由0价降低为-2价,化合价总共降低4价,根据化合价升降相等可知,NH4+系数为1,O2系数为2,根据N元素是可知NO3-系数为1,根据电荷守恒可知H+系数为2,根据元素守恒可知还生成H2O,其系数为1.
,O元素化合价由0价降低为-2价,化合价总共降低4价,根据化合价升降相等可知,NH4+系数为1,O2系数为2,根据N元素是可知NO3-系数为1,根据电荷守恒可知H+系数为2,根据元素守恒可知还生成H2O,其系数为1.
(1)元素的化合价升高为还原剂,元素的化合价降低被还原,以此来解答;
(2)铵态氮中的1mg氮,则NH4+的质量为1mg× ,根据(1)的离子方程式计算需要氧气的质量;
,根据(1)的离子方程式计算需要氧气的质量;
(3)反应中NO3-→NO,N元素化合价由+5价降低为+2价,Cu→Cu2+,Cu元素化合价由0价升高为+2价,根据电子转移守恒有2n(Cu)=3n(NO3-),根据N元素守恒有n(NH4+)=n(NO3-),再根据c= 计算;
计算;
点评:本题考查氧化还原反应的配平、根据方程式的计算、物质的量浓度计算等,根据守恒判断其它生成物是解题的关键.掌握化合价升降法配平氧化还原反应方程式,题目难度中等.
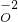 ,O元素化合价由0价降低为-2价,化合价总共降低4价,根据化合价升降相等可知,NH4+系数为1,O2系数为2,根据N元素是可知NO3-系数为1,根据电荷守恒可知H+系数为2,根据元素守恒可知还生成H2O,其系数为1,所以离子方程式为NH4++2O2=NO3-+2H++H2O.
,O元素化合价由0价降低为-2价,化合价总共降低4价,根据化合价升降相等可知,NH4+系数为1,O2系数为2,根据N元素是可知NO3-系数为1,根据电荷守恒可知H+系数为2,根据元素守恒可知还生成H2O,其系数为1,所以离子方程式为NH4++2O2=NO3-+2H++H2O.故答案为:1NH4+、2O2;1NO3-、2H+、1H2O;
(1)在氧化还原反应中,化合价升高的元素被氧化发生氧化反应,元素化合价降低的元素被还原,该反应中反应中NH4+→NO3-,N元素化合价由-3价升高为+5价,NH4+为还原剂,O2→
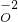 ,O元素化合价由0价降低为-2价,被还原的元素是O2中的O,电子由氮元素转移给氧元素,转移8个电子,
,O元素化合价由0价降低为-2价,被还原的元素是O2中的O,电子由氮元素转移给氧元素,转移8个电子,
故答案为:NH4+;O2中的O;
 ;
;(2)令需要氧气的质量为x,则:
NH4++2O2=NO3-+2H++H2O.
18g 64g
1mg×
 x
x所以x=
 ×1mg×
×1mg× =4.57mg
=4.57mg故答案为:4.57;
(3)反应中NO3-→NO,N元素化合价由+5价降低为+2价,Cu→Cu2+,Cu元素化合价由0价升高为+2价,根据电子转移守恒有2n(Cu)=3n(NO3-)=
 ×2=0.6mol,所以n((NO3-)=0.2mol,根据N元素守恒有n(NH4+)=n(NO3-)=0.2mol,所以原溶液中NH4+的浓度为
×2=0.6mol,所以n((NO3-)=0.2mol,根据N元素守恒有n(NH4+)=n(NO3-)=0.2mol,所以原溶液中NH4+的浓度为 =2mol/L.
=2mol/L.故答案为:2;
分析:由信息可知,O2将NH4+氧化为NO3-,根据电荷守恒可知,还生成H+,反应中NH4+→NO3-,N元素化合价由-3价升高为+5价,化合价总共升高8价,O2→
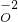 ,O元素化合价由0价降低为-2价,化合价总共降低4价,根据化合价升降相等可知,NH4+系数为1,O2系数为2,根据N元素是可知NO3-系数为1,根据电荷守恒可知H+系数为2,根据元素守恒可知还生成H2O,其系数为1.
,O元素化合价由0价降低为-2价,化合价总共降低4价,根据化合价升降相等可知,NH4+系数为1,O2系数为2,根据N元素是可知NO3-系数为1,根据电荷守恒可知H+系数为2,根据元素守恒可知还生成H2O,其系数为1.(1)元素的化合价升高为还原剂,元素的化合价降低被还原,以此来解答;
(2)铵态氮中的1mg氮,则NH4+的质量为1mg×
 ,根据(1)的离子方程式计算需要氧气的质量;
,根据(1)的离子方程式计算需要氧气的质量;(3)反应中NO3-→NO,N元素化合价由+5价降低为+2价,Cu→Cu2+,Cu元素化合价由0价升高为+2价,根据电子转移守恒有2n(Cu)=3n(NO3-),根据N元素守恒有n(NH4+)=n(NO3-),再根据c=
 计算;
计算;点评:本题考查氧化还原反应的配平、根据方程式的计算、物质的量浓度计算等,根据守恒判断其它生成物是解题的关键.掌握化合价升降法配平氧化还原反应方程式,题目难度中等.

练习册系列答案
 新思维寒假作业系列答案
新思维寒假作业系列答案
相关题目