题目内容
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题: 一定温度下,在一恒容的密闭容器中,由CO和H2合成甲醇:
CO(g)+2H2(g)CH3OH(g)
①下列情形不能说明该反应已达到平衡状态的是(填序号).
A.每消耗1mol CO的同时生成2molH2B.混合气体总物质的量不变
C.CH3OH、CO、H2的浓度都不再发生变化D.生成CH3OH的速率与消耗CO的速率相等
②CO的平衡转化率(α)与温度、压强的关系如图所示.A、B两点的平衡常数K(A)K(B)(填“>”、“=”或“<”).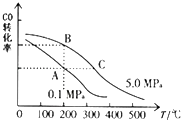
③某温度下,将2.0mol CO和6.0molH2充入2L的密闭容器中,达到平衡时测得c(CO)=0.25mol/L,CO的转化率= , 此温度下的平衡常数K=(保留两位有效数字).
【答案】D;=;75%;1.3
【解析】解:A.每消耗1molCO的同时生成2molH2 , 能证明正逆反应速率是相等的,故A错误; B、该反应是一个前后气体系数和变化的反应,当混合气体总物质的量不变,达到额化学平衡状态,故B错误;
C.CH3OH、CO、H2的浓度都不再发生变化,是化学平衡状态的特征,故C错误;
D.生成CH3OH的速率与消耗CO的速率相等,不能证明正逆反应速率是相等的,此时不一定达到化学平衡,故D正确.
故选D;②根据图中CO的平衡转化率(α)与温度、压强的关系,A、B两点的温度是一样的,所以平衡常数相等,所以答案是:=;③将2.0mol CO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则
CO(g)+ | 2H2(g) | ═ | CH3OH(g) | |
初始浓度: | 1.0 | 3.0 | 0 | |
变化浓度: | 0.75 | 1.5 | 0.75 | |
平衡浓度: | 0.25 | 1.5 | 0.75 |
CO的转化率 ![]() ×100%=75%,此温度下的化学平衡常数K=
×100%=75%,此温度下的化学平衡常数K= ![]() =
= ![]() ≈1.3,所以答案是:75%,1.3.
≈1.3,所以答案是:75%,1.3.
【考点精析】本题主要考查了化学平衡状态本质及特征和化学平衡状态的判断的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能正确解答此题.

 备战中考寒假系列答案
备战中考寒假系列答案