题目内容
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)?2SO3(g).反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是( )
|
分析:A.先计算二氧化硫的平均反应速率,根据方程式知,同一时间段内二氧化硫和三氧化硫的平均反应速率相等;
B.t2 时,参加反应的n(O2)=(0.060-0.016)mol=0.044mol,则参加反应的n(SO2)=2n(O2)=0.088mol,所以还属于n(SO2)=(0.10-0.088)mol=0.012mol,所以t1时该反应达到平衡状态,利用等效平衡分析;
C.升高温度,平衡向吸热反应方向移动,根据二氧化硫的平衡浓度大小判断反应热;
D.第一次达到平衡状态时二氧化硫的转化率=
×100%=88%,减小压强,平衡向气体体积增大的方向移动,根据平衡移动方向确定二氧化硫的转化率变化.
B.t2 时,参加反应的n(O2)=(0.060-0.016)mol=0.044mol,则参加反应的n(SO2)=2n(O2)=0.088mol,所以还属于n(SO2)=(0.10-0.088)mol=0.012mol,所以t1时该反应达到平衡状态,利用等效平衡分析;
C.升高温度,平衡向吸热反应方向移动,根据二氧化硫的平衡浓度大小判断反应热;
D.第一次达到平衡状态时二氧化硫的转化率=
| 0.088mol |
| 0.1mol |
解答:解:A.在0~t1 min内的平均速率为v(SO3)=
=
mol/(L.min),故A错误;
B.t2 时,参加反应的n(O2)=(0.060-0.016)mol=0.044mol,则参加反应的n(SO2)=2n(O2)=0.088mol,所以还属于n(SO2)=(0.10-0.088)mol=0.012mol,所以t1时该反应达到平衡状态;其它条件不变,起始时向容器中充入0.10molSO3和0.010 molO2与起始时向容器中充入0.10mol二氧化硫和0.060mol氧气相同,所以达到平衡状态时n(SO2)=0.012 mol,故B正确;
C.升高温度,平衡向吸热反应方向移动,如果平衡时c(SO2)=0.0070mol?L-1>
=0.006mol/L,则平衡向逆反应方向移动,所以正反应是放热反应,故C错误;
D.第一次达到平衡状态时二氧化硫的转化率=
×100%=88%,起始时向容器中充入0.050molSO2和0.030molO2,与第一次相比,相当于减小压强,平衡向逆反应方向移动,所以达到平衡时SO2转化率小于88%,故D正确;
故选BD.
| ||
| t1 |
| 0.044 |
| t1 |
B.t2 时,参加反应的n(O2)=(0.060-0.016)mol=0.044mol,则参加反应的n(SO2)=2n(O2)=0.088mol,所以还属于n(SO2)=(0.10-0.088)mol=0.012mol,所以t1时该反应达到平衡状态;其它条件不变,起始时向容器中充入0.10molSO3和0.010 molO2与起始时向容器中充入0.10mol二氧化硫和0.060mol氧气相同,所以达到平衡状态时n(SO2)=0.012 mol,故B正确;
C.升高温度,平衡向吸热反应方向移动,如果平衡时c(SO2)=0.0070mol?L-1>
| 0.012mol |
| 2L |
D.第一次达到平衡状态时二氧化硫的转化率=
| 0.088mol |
| 0.1mol |
故选BD.
点评:本题考查化学平衡有关计算、等效平衡等知识点,明确等效平衡中采用“极限转化”的方法分析解答,结合外界条件对化学平衡的影响来分析,难度较大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196kJ?moL-1,一段时间后达平衡,反应过程中测定的部分数据见下表:
下列说法不正确的是( )
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A、反应在前5min的平均速率为v(SO2)=0.08mol?L-1 min-1 |
| B、保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v(正)>v(逆) |
| C、保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
| D、相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40% |
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g)?2SO3(g)反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是( )
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 0.10 | 0.060 |
| t1 | 0.012 | |
| t2 | 0.016 |
| A、相同温度下,起始时向容器中充入0.050mol SO2和0.030mol O2,达到平衡时SO2转化率小于88% | ||
| B、保持其他条件不变,起始时向容器中充入0.10mol SO3和0.010 mol O2,到达平衡时,n(SO2)=0.0012 mol | ||
| C、保持其他条件不变,升高温度,平衡时c(SO2)=0.0070mol?L-1,则反应的△H>0 | ||
D、反应在0~t1 min内的平均速率为v(SO3)=
|
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)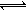 2SO3(g)
∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g)
∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
|
反应时间/min |
n(SO2)/mol |
n(O2)/mol |
|
0 |
2 |
1 |
|
5 |
1.2 |
|
|
10 |
|
0.4 |
|
15 |
0.8 |
|
下列说法不正确的是
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1 min−1
B.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%