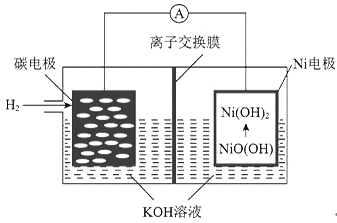
题目内容
【题目】下图是实验室用铜片与浓硫酸制取SO2并验证其性质的装置图。往试管Ⅰ中加入一小块铜片,再加入3~5mL 浓硫酸,用带导管的单孔橡胶塞塞好试管,加热,将生成的气体通入试管Ⅱ的溶液中。
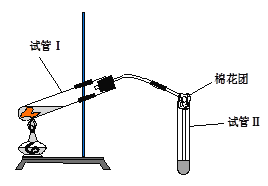
⑴若试管Ⅱ中的溶液是石蕊试液,反应一段时间后,试管Ⅱ中看到的现象是_______________
_______________________,表明生成的SO2气体水溶液具有_____性,SO2与水反应的化学方程式为:__________________________________。
⑵若试管Ⅱ中的溶液是品红试液,反应一段时间后,看到的现象是_____________________,说明SO2具有________性。反应充分后,取下试管Ⅱ并在酒精灯上加热,看到的现象是__________________________________________________________
⑶实验过程中,试管Ⅱ管口塞一团浸有NaOH溶液的棉花,作用是_______________,有关反应的离子方程式为: ________________________。
【答案】 略 略 略 略 略 略 略 略 略
【解析】⑴若试管Ⅱ中的溶液是石蕊试液,反应一段时间后,试管Ⅱ中看到的现象是导管口有气泡冒出,溶液变红,表明生成的SO2气体水溶液具有酸性,SO2与水反应的化学方程式为:SO2+H2O=H2SO3;⑵若试管Ⅱ中的溶液是品红试液,反应一段时间后,看到的现象是导管口有气泡冒出,溶液红逐渐褪去,说明SO2具有漂白性。反应充分后,取下试管Ⅱ并在酒精灯上加热,看到的现象是溶液逐渐变红;⑶实验过程中,试管Ⅱ管口塞一团浸有NaOH溶液的棉花,作用是吸收多余的二氧化硫,防止污染空气,有关反应的离子方程式为:SO2+2NaOH=H2O +Na2SO3。

【题目】某课外兴趣小组进行电解原理的实验探究,做了如下的实验:以铜为电极,按如图所示的装置电解饱和食盐水。
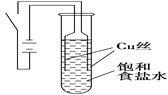
实验现象:接通电源30 s内,阳极附近出现白色浑浊,之后变成橙黄色浑浊,此时测定溶液的pH约为10。一段时间后,试管底部聚集大量红色沉淀,溶液仍为无色。
查阅资料:
物质 | 氯化铜 | 氧化亚铜 | 氢氧化亚铜(不稳定) | 氯化亚铜 |
颜色 | 固体呈棕色,浓溶液呈绿色,稀溶液呈蓝色 | 红色 | 橙黄色 | 白色 |
※ 相同温度下CuCl的溶解度大于CuOH。
下列说法错误的是( )
A. 反应结束后最终溶液呈碱性 B. 阴极上发生的电极反应为:2H2O + 2e- == H2↑+ 2OH-
C. 电解过程中氯离子移向阳极 D. 试管底部红色的固体具有还原性