题目内容
下列叙述中正确的是( )
分析:A.物质的溶解不等于物质的电离;
B.三氧化硫是非电解质;
C.根据硫酸钠的物质的量及硫酸钠的化学式进行计算;
D.亚硫酸是二元弱酸,在水溶液里只有部分电离.
B.三氧化硫是非电解质;
C.根据硫酸钠的物质的量及硫酸钠的化学式进行计算;
D.亚硫酸是二元弱酸,在水溶液里只有部分电离.
解答:解:A.某些物质会以分子形式溶于水,并不一定会电离,如乙醇等,故A错误;
B.三氧化硫和水反应生成硫酸,硫酸电离出阴阳离子而使其溶液导电,电离出阴阳离子的物质是硫酸而不是三氧化硫,所以三氧化硫是非电解质,故B错误;
C.根据题意知,硫酸钠的物质的量是0.1mol,一个硫酸钠化学式中含有2个钠离子,且钠离子不水解,所以钠离子的物质的量是0.2mol,故C正确;
D.亚硫酸是二元弱酸,在水溶液里只有部分电离,所以氢离子浓度小于0.2 mol,故D错误;
故选:C.
B.三氧化硫和水反应生成硫酸,硫酸电离出阴阳离子而使其溶液导电,电离出阴阳离子的物质是硫酸而不是三氧化硫,所以三氧化硫是非电解质,故B错误;
C.根据题意知,硫酸钠的物质的量是0.1mol,一个硫酸钠化学式中含有2个钠离子,且钠离子不水解,所以钠离子的物质的量是0.2mol,故C正确;
D.亚硫酸是二元弱酸,在水溶液里只有部分电离,所以氢离子浓度小于0.2 mol,故D错误;
故选:C.
点评:本题考查了电解质和非电解质的判断、弱电解质的电离等知识点,明确强弱电解质的判断方法、弱电解质电离特点即可解答,易错选项是B,注意二氧化硫、三氧化硫、二氧化碳等都是非电解质,为易错点.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
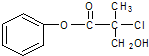 有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )
有机物A是农药生产中的一种中间体,结构简式如图所示.下列叙述中正确的是( )| A、有机物A可以在一定条件下与HBr发生反应 | B、1mol A最多能与4mol H2发生加成反应 | C、有机物A与浓硫酸混合加热,可以发生消去反应 | D、1mol A与足量的NaOH溶液反应,最多可以消耗3mol NaOH |


