��Ŀ����
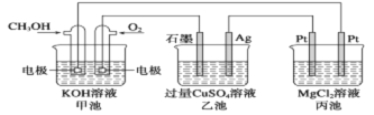
����Ŀ��ijѧ��������ͼʵ��װ��̽������ʽԭ��صĹ���ԭ��������Ҫ�����λش��������⣺

��1��д����������ԭ��Ӧ�����ӷ���ʽ��_______________
��2��װ���������г�������֬�⣬��Ҫ����KCl�ı�
����Һ����ع���ʱ���������е�K����Cl������
������ı�����ȷ����________��
A�������е�K��������ձ��ƶ���Cl�����Ҳ��ձ��ƶ�
B�������е�K�����Ҳ��ձ��ƶ���Cl��������ձ��ƶ�
C�������е�K����Cl����������ձ��ƶ�
D�������е�K����Cl�����������ƶ�
��3����֪��ԭ���װ���ڷ�Ӧǰ���缫������ȣ�һ��ʱ��������������12.9 g
������ͨ���ĵ�����ĿΪ________ (�á�NA����ʾ)��
��4�������Ի�ѧ��Ӧ��2Zn��O2��4H��=2Zn2����2H2OΪ�������һ��ԭ��أ�������������Ϊ������������Դ�����ǿ�������ѪҺ������һ��Ũ�ȵ�O2��H����Zn2�����й�������ԭ��صĸ���������________�����������ĵ缫��ӦΪ��__________________��
��5����CH4��O2����γɵ����ӽ���Ĥȼ�ϵ�صĽṹʾ��ͼ���£�����d�缫��________�����������������C�缫�ķ�Ӧ����ʽΪ��_____________

������·��ת��4 mol���ӣ�������ȼ�ϵ�����ĵ�O2�ڱ�״���µ����Ϊ____L��
�۵�ع���һ��ʱ�����Һ������_________�����ǿ�������������䡱��
���𰸡� Zn + Cu2+ = Zn2+ + Cu B 0.2 NA п��Zn O2+4e- +4H��=2H2O ���� CH4��8e����2H2O===CO2��8H�� 22.4 ����
����������1��ԭ����з������Է���������ԭ��Ӧ��Zn������ͭ��Һ�ķ�Ӧ�������ӷ���ʽΪZn + Cu2+ = Zn2+ + Cu��
��2������ձ���пʧ���ӱ��п���ӣ�ʹ��п�缫����������ɣ�����������������ձ��ƶ����Ҳ��ձ���ͭ���ӵõ����ӱ��ͭ��ʹ��ͭ�缫����������ɣ��������������Ҳ��ձ��ƶ����������е�K+���Ҳ��ձ��ƶ���Cl-������ձ��ƶ���
�ʴ�ΪB��
��3��ZnΪ���������ĵ缫��ӦΪZn-2e-=Zn2+��CuΪ���������ĵ缫��ӦΪCu2++2e- = Cu����ת�Ƶ��ӵ����ʵ���Ϊnmol��һ��ʱ��������������12.9 gʱ��64g/mol��![]() +65g/mol��
+65g/mol��![]() =12.9g�����n=0.2mol��������ͨ���ĵ�����ĿΪ0.2 NA ��
=12.9g�����n=0.2mol��������ͨ���ĵ�����ĿΪ0.2 NA ��
(4) �ɷ�Ӧ2Zn+O2+4H+�T2Zn2++2H2O��֪��Zn����������Zn2+��Ϊ������Ӧ������������������ԭ��Ӧ���缫����ʽΪO2+4e- +4H��=2H2O��
��5������c�ǵ���������һ������cΪ������dΪ������������л�ԭ�ԣ��ڸ����Ϸ���������Ӧ����CO2���缫��ӦʽΪ��CH4-8e-+2H2O�TCO2+8H+��
��ԭ����������缫��ӦΪ2O2+8H++8e-�T4H2O����ת��4mol����ʱ���������������ʵ���Ϊ1.0mol�����Ϊ1.0mol��22.4L/mol=22.4L��
��ԭ��ع������ܵ缫��ӦʽΪ2O2+CH4�TCO2+2H2O����Һ��H+���ʵ������䣬����Һ��ˮ�������࣬���ع���һ��ʱ�����Һ�����Լ�����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�