题目内容
下列实验的操作和结论正确的是
| A.将0.1 mol Na和少量 Al 片放入水溶液中,放出气体刚好是0.05 mol |
| B.Na2O2投入到 FeCl2溶液中只得到大量白色沉淀 |
| C.镁粉中混有铝粉,可与NaOH溶液反应再过滤,得到镁粉 |
| D.配制一定物质的量浓度溶液,定容时仰视容量瓶刻度线,使所得溶液浓度偏大 |
C
试题分析:A.2Na+2H2O=2NaOH+H2,2Al+6H2O=2Al(OH)3+3H2,2molNa和少量 Al 片与水反应共放出氢气4mol,因此0.1mol反应产生的气体为0.2mol,故错误。B. Na2O2投入到 FeCl2溶液,Na2O2先与溶液中的水发生2Na2O2+2H2O=4NaOH+O2↑反应,产生氧气,FeCl2与产生的NaOH反应生成Fe(OH)2白色沉淀,由于Fe(OH)2不稳定,白色沉淀会迅速变成灰绿色,最后变为红褐色。反应现象中还应产生气体,故错误。C. 镁粉中混有铝粉,当与NaOH溶液反应时,Mg与NaOH溶液不发生反应,而Al则与过量的NaOH溶液反应生成氢气与NaAlO2,经过过滤可得到镁粉,故正确。D.在配制一定物质的量浓度溶液时,定容时仰视刻度线,会使加入的水的体积超过刻度线,使溶液的体积偏大,致使溶液浓度偏小。3的两性、配制一定浓度的溶液时的误差问题。

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
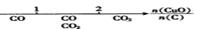
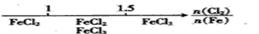
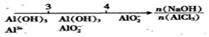
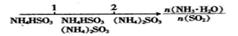
 CaO
CaO  Ca(OH)2
Ca(OH)2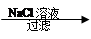 NaOH溶液
NaOH溶液
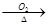 CuO
CuO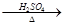 CuSO4溶液
CuSO4溶液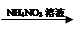 Cu(NO3)2溶液
Cu(NO3)2溶液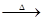 O2
O2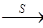 SO3
SO3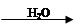 H2SO4
H2SO4 NO
NO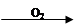 NO2
NO2 HNO3
HNO3