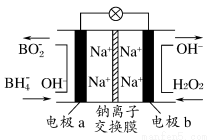
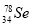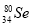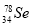题目内容
使18g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:C(s)+1/2O2(g)=CO(g);ΔH=-Q1kJ/mol;CO(g)+1/2 O2(g)=CO2(g);ΔH=-Q2 kJ/mol。与这些焦炭完全燃烧相比较,损失的热量是 ( )
A.1/3Q1 kJ B.1/3Q2 kJ C.1/3(Q1+Q2) kJ D.1/2Q2 kJ
D
【解析】18 g焦炭的物质的量为1.5 mol,其中有1/3生成CO,即0.5 mol C反应生成了CO气体,根据盖斯定律,知损失的热量为0.5 mol CO燃烧生成CO2所放出的热量,即0.5Q2,选D。

练习册系列答案
相关题目