题目内容
碘元素缺乏会引起甲状腺疾病,为预防碘缺乏我国卫生部规定每千克食盐中应含有40~50mg KIO3.某化学活动小组设计实验,验证某食盐样品中是否含碘和检查该食盐是否为合格产品.
(1)完成下列实验报告:
| 实验步骤 | 实验现象 | 实验结论(步骤2用离子方程式表示) |
| 1.取食盐少许于一支试管中,加入适量的蒸馏水,振荡. | 固体完全溶解 | 食盐及碘酸钾都能溶于水 |
| 2.向上述溶液中滴加适量的亚硫酸氢钠溶液,振荡 | 溶液出现棕黄色 | ______ |
| 3.______ | 溶液变成蓝色 | ______ |
(3)该同学取该食盐样品100.0g完全溶解于水中,然后加入用盐酸酸化的淀粉-KI溶液,结果溶液呈蓝色,则反应的离子方程式为______.
为进一步确证样品是否为合格产品,该同学又用0.0100mol?L-1的Na2S2O3溶液滴定,当用去10.00mL时蓝色刚好褪去(反应方程式为I2+2S2O32-═2I-+S4O62-),通过计算该加碘食盐中KIO3的含量为______mg/kg(保留一位小数),由此可判定该食盐为______(填“合格”或“不合格”)产品,滴定时盛放Na2S2O3溶液用______滴定管(填“酸式”或“碱式”)
(4)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和电流下电解KI溶液.总反应方程式为KI+3H2O═KIO3+3H2↑,则阳极的电极反应式为______;阴极附近pH值______(填“增大”“减小”或“不变”)
解:(1)由于食盐及碘酸钾溶于水后的溶液中,滴加适量的亚硫酸氢钠溶液,碘酸钾能够将亚硫酸氢离子反应生成单质碘和硫酸根离子;溶液变成蓝色,根据碘的特性判断实验中加入了淀粉溶液;滴加淀粉溶液,淀粉遇到碘变蓝,
故答案为:
(2)由于氯酸钾热稳定性差,加热容易分解,所以食用时待食品熟后加入,
故答案为:防止KIO3分解;
(3)IO3-具有氧化性,在酸性条件下与具有还原性的I-发生氧化还原反应生成I2,反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O;
(4)根据反应IO3-+5I-+6H+=3I2+3H2O,以及I2+2S2O32-(无色)→2I-+S4O62-(无色),得出反应的关系式IO3-~3I2~6S2O32-,
又n(Na2S2O3)=0.010mol/L×0.012L=0.00012mol,
则IO3-~3I2~6S2O32-
1 6
n(IO3-) 0.00010mol
解得:n(IO3-)=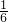 ×0.00010mol,
×0.00010mol,
m(KIO3)=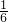 ×0.00010mol×214g/mol=0.00428g=3.57mg,
×0.00010mol×214g/mol=0.00428g=3.57mg,
所以1kg食盐中:m(KIO3)=10×4.28mg=35.7mg<40mg,
所以该食盐不合格,
由于硫代硫酸钠属于强碱弱酸盐,其溶液显示碱性,所以应该使用碱式滴定管盛装;
故答案为:5I-+IO3-+6H+═3I2+3H2O; 35.7;不合格; 碱式;
(5)电解法制KIO3中,阳极发生氧化反应,电极反应式为I-+3H2O-6e-=IO3-+6H+,阴极反应式为:2H2O+2e-=H2↑+2OH-,阴极PH增大,
故答案为:I--6e-+3H2O═IO3-+6H+; 增大.
分析:(1)食盐及碘酸钾溶于水后的溶液中,滴加适量的亚硫酸氢钠溶液,碘酸钾能够将亚硫酸氢离子反应生成单质碘和硫酸根离子;溶液变成蓝色,根据碘的特性判断实验中加入了淀粉溶液;滴加淀粉溶液,淀粉遇到碘变蓝;
(2)根据碘酸钾稳定性差进行分析;
(3)IO3-具有氧化性,在酸性条件下与具有还原性的I-发生氧化还原反应生成I2;
(4)根据反应方程式找出关系式IO3-~3I2~6S2O32-,再利用滴定数据计算出碘酸钾的质量,最后计算出1Kg食用盐中含有的碘酸钾质量,根据计算结果判定该盐是否合格;硫代硫酸钠属于强碱弱酸盐,溶液显示碱性;
(5)电解法制KIO3中,阳极的电极反应式为I-+3H2O-6e-=IO3-+6H+,阴极反应式为:2H2O+2e-=H2↑+2OH-,以此判断.
点评:本题考查较为综合,涉及电化学、离子方程式的书写以及物质含量的测定,题目难度中等,解答时注意把握反应的关系式.
故答案为:
| 实验步骤 | 实验现象 | 实验结论(步骤2用 离子方程式表示) |
| 2IO3-+5HSO3-═I2+5SO42-+3H++H2O | ||
| 再向上述溶液中滴加淀粉溶液,振荡 | 淀粉遇碘变蓝 |
故答案为:防止KIO3分解;
(3)IO3-具有氧化性,在酸性条件下与具有还原性的I-发生氧化还原反应生成I2,反应的离子方程式为IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O;
(4)根据反应IO3-+5I-+6H+=3I2+3H2O,以及I2+2S2O32-(无色)→2I-+S4O62-(无色),得出反应的关系式IO3-~3I2~6S2O32-,
又n(Na2S2O3)=0.010mol/L×0.012L=0.00012mol,
则IO3-~3I2~6S2O32-
1 6
n(IO3-) 0.00010mol
解得:n(IO3-)=
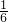 ×0.00010mol,
×0.00010mol,m(KIO3)=
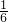 ×0.00010mol×214g/mol=0.00428g=3.57mg,
×0.00010mol×214g/mol=0.00428g=3.57mg,所以1kg食盐中:m(KIO3)=10×4.28mg=35.7mg<40mg,
所以该食盐不合格,
由于硫代硫酸钠属于强碱弱酸盐,其溶液显示碱性,所以应该使用碱式滴定管盛装;
故答案为:5I-+IO3-+6H+═3I2+3H2O; 35.7;不合格; 碱式;
(5)电解法制KIO3中,阳极发生氧化反应,电极反应式为I-+3H2O-6e-=IO3-+6H+,阴极反应式为:2H2O+2e-=H2↑+2OH-,阴极PH增大,
故答案为:I--6e-+3H2O═IO3-+6H+; 增大.
分析:(1)食盐及碘酸钾溶于水后的溶液中,滴加适量的亚硫酸氢钠溶液,碘酸钾能够将亚硫酸氢离子反应生成单质碘和硫酸根离子;溶液变成蓝色,根据碘的特性判断实验中加入了淀粉溶液;滴加淀粉溶液,淀粉遇到碘变蓝;
(2)根据碘酸钾稳定性差进行分析;
(3)IO3-具有氧化性,在酸性条件下与具有还原性的I-发生氧化还原反应生成I2;
(4)根据反应方程式找出关系式IO3-~3I2~6S2O32-,再利用滴定数据计算出碘酸钾的质量,最后计算出1Kg食用盐中含有的碘酸钾质量,根据计算结果判定该盐是否合格;硫代硫酸钠属于强碱弱酸盐,溶液显示碱性;
(5)电解法制KIO3中,阳极的电极反应式为I-+3H2O-6e-=IO3-+6H+,阴极反应式为:2H2O+2e-=H2↑+2OH-,以此判断.
点评:本题考查较为综合,涉及电化学、离子方程式的书写以及物质含量的测定,题目难度中等,解答时注意把握反应的关系式.

练习册系列答案
相关题目
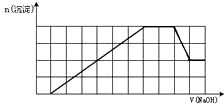 某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,由此可知
某溶液中可能含有H+、K+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,由此可知