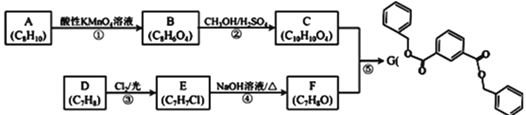
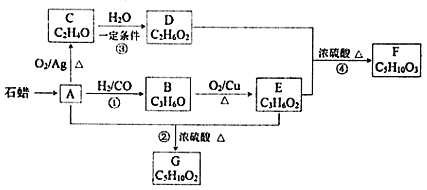
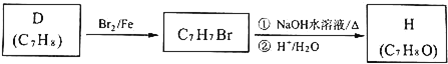ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩΝΫ÷÷―ΈΒΡœΓ»ή“ΚΘΚamolΓΛL-1NaX»ή“ΚΚΆbmolΓΛL-1NaY»ή“ΚΓΘœ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «Θ® Θ©
A.»τa=bΘ§«“pH(NaX)>pH(NaY)Θ§‘ρΥα–‘HX<HY
B.»τa>bΘ§«“c(X-)=c(Y-)Θ§‘ρ»ή“Κ÷–c(HX)>c(HY)
C.»τa=bΘ§«“c(X-)=c(Y-)+c(HY)Θ§‘ρHXΈΣ«ΩΥα
D.»τΝΫ»ή“ΚΒ»ΧεΜΐΜλΚœΚσc(X-)+c(HX)=c(Y-)+c(HY)=0.1molΓΛL-1Θ§‘ρa=b=0.1molΓΛL-1
ΓΨ¥πΑΗΓΩD
ΓΨΫβΈωΓΩ
![]() ΝΫ÷÷»ή“Κ≈®Ε»œύΆ§Θ§
ΝΫ÷÷»ή“Κ≈®Ε»œύΆ§Θ§![]() Θ§ΥΒΟςNaXΒΡΦν–‘Ηϋ«ΩΘ§Ε‘”ΠΒΡ
Θ§ΥΒΟςNaXΒΡΦν–‘Ηϋ«ΩΘ§Ε‘”ΠΒΡ![]() ΒΡΥ°Ϋβ≥ΧΕ»Ηϋ«ΩΘ§“ρ¥ΥΥα–‘
ΒΡΥ°Ϋβ≥ΧΕ»Ηϋ«ΩΘ§“ρ¥ΥΥα–‘![]() Θ§Ι A’ΐ»ΖΘΜ
Θ§Ι A’ΐ»ΖΘΜ
B.![]() ≤Δ«“
≤Δ«“![]() Θ§ΗυΨίΈοΝœ ΊΚψ
Θ§ΗυΨίΈοΝœ ΊΚψ![]() Θ§
Θ§![]() Θ§Υυ“‘»ή“Κ÷–
Θ§Υυ“‘»ή“Κ÷–![]() Θ§Ι B’ΐ»ΖΘΜ
Θ§Ι B’ΐ»ΖΘΜ
C.![]() «“
«“![]() Θ§“ρ¥ΥΩ…“‘Ω¥≥ω
Θ§“ρ¥ΥΩ…“‘Ω¥≥ω![]() ΟΜ”–Υ°ΫβΘ§“ρ¥ΥHXΈΣ«ΩΥαΘ§Ι C’ΐ»ΖΘΜ
ΟΜ”–Υ°ΫβΘ§“ρ¥ΥHXΈΣ«ΩΥαΘ§Ι C’ΐ»ΖΘΜ
D.ΝΫ÷÷»ή“ΚΜλΚœ“‘«ΑΘ§ΗυΨίΈοΝœ ΊΚψ![]() Θ§
Θ§![]() Θ§»τΒ»ΧεΜΐΜλΚœΘ§‘ρΜλΚœΚσΒΡΧεΜΐ «ΜλΚœ«ΑΒΡΝΫ±ΕΘ§¥Υ ±cΘ®X-Θ©+cΘ®HXΘ©=
Θ§»τΒ»ΧεΜΐΜλΚœΘ§‘ρΜλΚœΚσΒΡΧεΜΐ «ΜλΚœ«ΑΒΡΝΫ±ΕΘ§¥Υ ±cΘ®X-Θ©+cΘ®HXΘ©=![]() Θ§cΘ®Y-Θ©+cΘ®HYΘ©=
Θ§cΘ®Y-Θ©+cΘ®HYΘ©=![]() Θ§”÷“ρΈΣcΘ®X-Θ©+cΘ®HXΘ©=cΘ®Y-Θ©+cΘ®HYΘ©=0.1mol/LΘ§‘ρa=b=0.2Θ§Ι D¥μΈσΘΜ
Θ§”÷“ρΈΣcΘ®X-Θ©+cΘ®HXΘ©=cΘ®Y-Θ©+cΘ®HYΘ©=0.1mol/LΘ§‘ρa=b=0.2Θ§Ι D¥μΈσΘΜ
Ι ―ΓΘΚDΓΘ

 “Μ±ΨΚΟΧβΩΎΥψΧβΩ®œΒΝ–¥πΑΗ
“Μ±ΨΚΟΧβΩΎΥψΧβΩ®œΒΝ–¥πΑΗΓΨΧβΡΩΓΩΙη‘ΎΒΊΩ«÷–ΒΡΚ§ΝΩΫœΗΏΓΘΙηΦΑΤδΜ·ΚœΈοΒΡΩΣΖΔ”…ά¥“―ΨΟΘ§‘Ύœ÷¥ζ…ζΜν÷–”–ΙψΖΚ”Π”ΟΓΘΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©1810Ρξ»πΒδΜ·―ßΦ“±¥≤…άϊΈΎΥΙ‘ΎΦ”»» ·”Δ…ΑΓΔΡΨΧΩΚΆΧζ ±Θ§ΒΟΒΫ“Μ÷÷ΓΑΫπ τΓ±ΓΘ’β÷÷ΓΑΫπ τΓ±Ω…Ρή «_______ΓΘ
Θ®2Θ©Χ’¥…ΓΔΥ°ΡύΚΆ≤ΘΝß «≥Θ”ΟΒΡΙηΥα―Έ≤ΡΝœΓΘΤδ÷–Θ§…ζ≤ζΤ’Ά®≤ΘΝßΒΡ÷ς“Σ‘≠Νœ”–_______ΓΘ
Θ®3Θ©ΗΏ¥ΩΙη «œ÷¥ζ–≈œΔΓΔΑκΒΦΧεΚΆΙβΖϋΖΔΒγΒ»≤ζ“ΒΕΦ–η“ΣΒΡΜυ¥Γ≤ΡΝœΓΘΙΛ“Β…œΧα¥ΩΙη”–Εύ÷÷¬ΖœΏΘ§Τδ÷–“Μ÷÷ΙΛ“’Νς≥Χ Ψ“βΆΦΦΑ÷ς“ΣΖ¥”Π»γœ¬ΘΚ
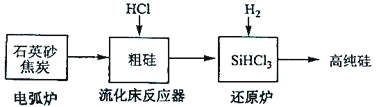
ΖΔ…ζΒΡ÷ς“ΣΖ¥”Π | |
ΒγΜΓ¬· | SiO2+2C |
ΝςΜ·¥≤Ζ¥”ΠΤς | Si+3HCl |
ΜΙ‘≠¬· | SiHCl3+H2 |
ΔΌ”Ο ·”Δ…ΑΚΆΫΙΧΩ‘ΎΒγΜΓ¬·÷–ΗΏΈ¬Φ”»»“≤Ω…“‘…ζ≤ζΧΦΜ·ΙηΘ§ΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ_______ΘΜΧΦΜ·Ιη”÷≥Τ_______Θ§ΤδΨßΧεΫαΙΙ”κ_______œύΥΤΓΘ
ΔΎ‘ΎΝςΜ·¥≤Ζ¥”ΠΒΡ≤ζΈο÷–Θ§SiHCl3¥σ‘Φ’Φ85%Θ§ΜΙ”–SiCl4ΓΔSiH2Cl2ΓΔSiH3ClΒ»Θ§”–ΙΊΈο÷ ΒΡΖ–Βψ ΐΨί»γœ¬±μΘ§Χα¥ΩSiHCl3ΒΡ÷ς“ΣΙΛ“’≤ΌΉς“ά¥Έ «≥ΝΫΒΓΔάδΡΐΚΆ_______ΓΘ
Έο÷ | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
Ζ–Βψ/Γφ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
ΔέSiHCl3ΦΪ“ΉΥ°ΫβΘ§ΤδΆξ»ΪΥ°ΫβΒΡ≤ζΈοΈΣ_______ΓΘ
Θ®4Θ©¬»ΦνΙΛ“ΒΩ…ΈΣ…œ ωΙΛ“’…ζ≤ζΧαΙ©≤ΩΖ÷‘≠ΝœΘ§’β–©‘≠Νœ «_______ΓΘ
ΓΨΧβΡΩΓΩ“―÷Σ≤ίΥα(H2C2O4) «“Μ÷÷Εΰ‘Σ»θΥαΘ§≤ίΥαΦΑΤδ―ΈΙψΖΚ”Ο”Ύ“Ϋ“©ΓΔ”Γ»ΨΓΔΥήΝœΒ»ΙΛ“ΒΓΘ
Θ®1Θ©“―÷Σ25Γφ ±Θ§ΦΗ÷÷≥ΘΦϊ»θΥαΒΡKa»γœ¬±μΥυ ΨΘΚ
ΒγΫβ÷ | H2C2O4 | CH3COOH | HCN | H2CO3 |
Βγάκ≥Θ ΐ(molΓΛL-1) | K1=5.6ΓΝ10-2 K2=5.4ΓΝ10-3 | K1=1.7ΓΝ10-5 | K2=6.2ΓΝ10-10 | K1=4.2ΓΝ10-7 K2=5.6ΓΝ10-11 |
ΔΌ25Γφ ±Θ§≈®Ε»ΨυΈΣ0.1molΓΛL-1ΒΡNa2C2O4ΓΔCH3COONaΓΔNaCNΓΔNa2CO3ΒΡpH”…¥σΒΫ–ΓΒΡΥ≥–ρ «___ΓΘ÷–ΚΆΒ»ΧεΜΐΓΔΒ»pHΒΡHCOOHΚΆHCNœϊΚΡNaOHΒΡΝΩ___(ΧνΓΑ«Α’Ώ¥σΓ±ΓΑΚσ’Ώ¥σΓ±ΜρΓΑœύȖ)ΓΘ
ΔΎœ¬Ν–ΙΊ”Ύ0.1molΓΛL-1NaHC2O4»ή“ΚΒΡΥΒΖ®’ΐ»ΖΒΡ «___ΓΘ
a.HC2O4-ΒΡΒγάκ≥ΧΕ»¥σ”ΎΥ°Ϋβ≥ΧΕ»Θ§»ή“Κœ‘Υα–‘
b.HC2O4-ΒΡΥ°Ϋβ≥ΧΕ»¥σ”ΎΒγάκ≥ΧΕ»≥ΧΕ»Θ§»ή“Κœ‘Φν–‘
c.»ή“Κ÷–c(Na+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-)
d.»ή“Κ÷–c(H+)=c(OH-)+c(C2O42-)-c(H2C2O4)
Θ®2Θ©‘ΎtΓφ ±Θ§MgC2O4‘ΎΥ°÷–ΒΡ≥ΝΒμ»ήΫβΤΫΚβ«ζœΏ»γΆΦ1Υυ ΨΓΘ”÷÷ΣtΓφ ±Mg(OH)2ΒΡKsp=5.6ΓΝ10-12Θ§œ¬Ν–ΥΒΖ®≤Μ’ΐ»ΖΒΡ «____
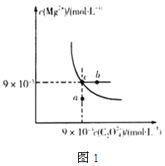
A.‘ΎtΓφ ±Θ§MgC2O4ΒΡKsp=8.1ΓΝ10-5mol2ΓΛL-2
B.‘ΎMgC2O4±ΞΚΆ»ή“Κ÷–Φ”»κNa2CO3ΙΧΧεΘ§Ω… Ι»ή“Κ”…cΒψΒΫbΒψ
C.ΆΦ÷–aΒψΕ‘”ΠΒΡ «MgC2O4ΒΡ≤Μ±ΞΚΆ»ή“Κ
D.‘ΎtΓφ ±Θ§MgC2O4(s)+2OH-(aq)Mg(OH)2(s)+C2O42-(aq)ΤΫΚβ≥Θ ΐK=![]()
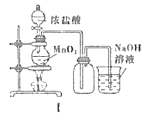
Θ®3Θ©≤ίΥα―«ΧζΨßΧε(FeC2O4ΓΛ2H2O) «“Μ÷÷«≥ΜΤ…ΪΙΧΧεΘ§Ρ―»ή”ΎΥ°Θ§ ή»»“ΉΖ÷ΫβΓΘΡ≥Μ·―ß–Υ»Λ–ΓΉι…ηΦΤ Β―ι―ι÷Λ≤ίΥα―«ΧζΨßΧε»»Ζ÷ΫβΒΡ≤ζΈοΘ§ΧΫΨΩΙΐ≥Χ»γΆΦ2ΘΚ
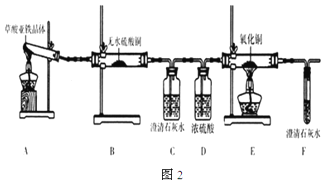
ΔΌ¥”ΜΖ±ΘΫ«Ε»ΩΦ¬«Θ§ΗΟΧΉ Β―ιΉΑ÷ΟΒΡΟςœ‘»±œί «___ΓΘ
ΔΎΗΟ–Υ»Λ–ΓΉιΫχ––…œ ω Β―ι ±Θ§¥” Β―ιΑ≤»ΪΫ«Ε»ΩΦ¬«Θ§”Πœ»Βψ»Φ___(ΧνΓΑAΓ±ΜρΓΑEΓ±)¥ΠΒΡΨΤΨΪΒΤΓΘ
Δέ»τ Β―ιΙΐ≥Χ÷–Ιέ≤λΒΫB÷–ΑΉ…ΪΈόΥ°CuSO4±δ≥…άΕ…ΪΘ§___(≤Ι≥δ Β―ιœ÷œσ)Θ§‘ρΩ…÷ΛΟς≤ίΥα―«ΧζΨßΧε»»Ζ÷ΫβΒΡΤχΧε≤ζΈο «H2OΓΔCOΚΆ
ΔήΈΣΧΫΨΩ≤ίΥα―«ΧζΨßΧεΖ÷ΫβΒΡΙΧΧε≤ζΈοΘ§–Υ»Λ–ΓΉιΆ§―ßΉΦ»Ζ≥Τ»Γ3.60g≤ίΥα―«ΧζΨßΧε(FeC2O4ΓΛ2H2O)Θ§œύΕ‘Ζ÷Ή”÷ ΝΩ «180)Θ§≥δΖ÷Φ”»»Θ§ ΙΤδΆξ»ΪΖ÷ΫβΘ§ά以Κσ≥ΤΒΟ Θ”ύΙΧΧεΒΡ÷ ΝΩΈΣ1.60gΓΘ»τ Θ”ύΙΧΧε÷Μ”–“Μ÷÷ΧζΒΡ―θΜ·ΈοΘ§Ά®ΙΐΦΤΥψ»ΖΕ®ΗΟ―θΜ·ΈοΒΡΜ·―ß ΫΈΣ___ΓΘ≤ίΥα―«ΧζΨßΧεΖ÷ΫβΒΡΜ·―ßΖΫ≥Χ ΫΈΣ___ΓΘ