题目内容
【题目】化学反应速率是化学反应原理的重要组成部分.请回答下列问题:
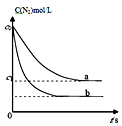
(1)已知一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)△H<0,在反应过程中,正反应速率的变化如图所示,请根据速率的变化回答采取的措施(改变的条件). 
(2)探究反应条件对0.l0mol/L,Na2S2O3溶液与稀H2SO4反应速率的影响.其设计与测定结果如表:
编号 | 反应温度/℃ | Na2S2O3浓液/mL | 甲 | 0.1mol/LH2SO4溶液/mL | 乙 |
① | 25℃ | 10.0 | 0 | 10.0 | |
② | 25℃ | 5.0 | a | 10.0 | |
③ | 45℃ | 10.0 | 0 | 10.0 |
上述实验①③是探究对化学反应速率的影响;若上述实验①②是探究浓度对化学反应速率的影响,则表格中“甲”为 , a为;乙是实验需要测量的物理量,则表格中“乙”为 .
(3)已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大. ①针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大.从影响化学反应速率的因素看,你猜想还可能是的影响.
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入(填字母序号).
A.硫酸钾B.氯化锰c.硫酸锰D.水.
【答案】
(1)加压或增大反应物浓度;加入催化剂;减压或减小反应物浓度;减小生成物浓度;
(2)温度;V(蒸馏水)/mL;5.0;出现浑浊的时间/min
(3)催化剂(或锰离子的催化作用);C
【解析】解:(1)2SO2(g)+O2(g)2SO3(g)△H<0,该反应是一个气体体积减小且正反应是放热的化学反应, t1时正反应速率增大,且平衡时反应速率小于t1时反应速率,则平衡向正反应方向移动,改变的条件为加压或增大反应物浓度;
t2时正反应速率增大,但平衡不移动,改变的条件为加入催化剂;
t3时正反应速率减小,且平衡时反应速率大于t3时反应速率,则平衡向逆反应方向移动,改变的条件为减压或减小反应物浓度;
t4时正反应速率不变,且平衡时反应速率小于t4时反应速率,则平衡向正反应方向移动,改变的条件为减小生成物浓度;
故答案为:加压或增大反应物浓度;加入催化剂;减压或减小反应物浓度;减小生成物浓度;(2)当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,通过比较实验①③的反应条件可知,实验①③可探究温度对反应速率的影响;实验①②中的Na2S2O3溶液的加入体积不同,故要探究Na2S2O3溶液浓度不同对反应速率的影响,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积相同,故甲应为V(蒸馏水)/mL,a的值为5.0;又Na2S2O3溶液与稀H2SO4反应生成二氧化硫和硫沉淀,则要准确描述反应速率的快慢,必须准确测得溶液出现浑浊时间的长短,故乙要测量的物理量是出现浑浊的时间/min;
故答案为:温度;V(蒸馏水)/mL;5.0;出现浑浊的时间/min;(3)①KMnO4与H2C2O4反应生成硫酸锰,锰离子有催化作用,所以猜想还可能是催化剂的作用,
故答案为:催化剂(或锰离子的催化作用);
②反应方程式2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑中,浓度变化较大的为锰离子,所以选择做催化剂的试剂应该含有锰离子,而(B)中氯化锰中也含Mn2+ , 却不能选为催化剂,原因就在于其中的Cl﹣易被酸性高锰酸钾溶液氧化,故只有C正确,
故选C.
(1)2SO2(g)+O2(g)2SO3(g)△H<0,该反应是一个气体体积减小且正反应是放热的化学反应,t1时正反应速率增大,且平衡时反应速率小于t1时反应速率,则平衡向正反应方向移动,t2时正反应速率增大,但平衡不移动,t3时正反应速率减小,且平衡时反应速率大于t3时反应速率,则平衡向逆反应方向移动,t4时正反应速率不变,且平衡时反应速率小于t4时反应速率,则平衡向正反应方向移动,根据外界条件对化学反应速率的影响来分析解答;(2)Na2S2O3溶液与稀H2SO4反应生成二氧化硫和硫沉淀,当探究某一种因素对反应速率的影响时,必须保持其他影响因素一致,要探究Na2S2O3溶液浓度不同对反应速率的影响,则加入的Na2S2O3溶液的体积不同,但反应体积溶液的总体积需相同,故应加入蒸馏水来确保溶液的总体积相同;要准确描述反应速率的快慢,必须准确测得溶液褪色时间的长短;(3)①影响反应速率的因素除了浓度、温度外,催化剂也影响反应速率;②根据反应方程式可知,反应产物中锰离子随着反应的进行,浓度变化较大,反应前加入硫酸锰,根据反应速率大小判断锰离子是否在该反应中起到催化作用.

【题目】工业上通常采用N2(g)和H2(g)崔华成NH3(g):N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJmol﹣1
(1)在一定温度下,若将10amolN2和30amolH2放入2L的密闭容器中,充分反应后测得平衡时N2的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).若此时再向该容器中投入10amolN2、20amolH2和20amolNH3 , 判断平衡移动的方向是(填“正向移动”“逆向移动”或“不移动”).
(2)若反应起始时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L.则NH3达到平衡时浓度的范围为;若平衡时N2、H2、NH3的浓度分别为0.1mol/L、0.3mol/L、0.1mol/L,则NH3起始时浓度的范围为 .
(3)一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 | |
平衡时数据 | 反应能量变化的绝对值(kJ) | Q1 | Q2 | Q3 |
反应物转化率 | a1 | a2 | a3 | |
体系压强(Pa) | p1 | P2 | P3 | |
则Q1+Q2=kJ;a1+a2l(填“<”“>”或“=”下同):2p2p3
(4)如图:A是恒容的密闭容器,B是一个体积可变的充气气囊.保持恒温,关闭K2 , 将1molN2和3molH2通过K3充入B中,将2molN2和6molH2通过K1充入A中;起始时A、B的体积相同均为1L,达到平衡时,V(B)=0.9L;然后打开K2 , 一段时间又达到平衡时,B的体积为L(连通管中气体体积不计). 
【题目】实验室制取乙烯的传统做法是采用浓硫酸做催化剂,由于浓硫酸具有具有脱水性和强氧性,生成乙烯同时产生CO2和SO2气体会影响乙烯的性质实验.某同学查阅相关资料后发现,可用脱水性更强的P2O5代替浓硫酸浓硫酸作为该实验的催化剂.为验证这一说法,该同学利用以下装置进行实验探究,观察并记录现象如下: 
实验一 | 实验二 | |
实验药品 | 4g P2O5、8mL无水乙醇 | |
实验条件 | 酒精灯加热 | 水浴加热 |
实验现象 | 无水乙醇加入时,圆底烧瓶B中P2O5溶于乙醇,立即产生白雾,当用酒精灯加热后,有气泡产生,并逐渐沸腾,生成粘稠状液体,集气瓶C中有无色液体产生. | 无水乙醇加入时,圆底烧瓶B中P2O5溶于乙醇立即产生白雾,当用水浴加热后,无气泡产生,生成粘稠状液体,集气瓶C中有无色液体产生. |
请回答下列问题:
(1)写出装置中仪器A的名称;
(2)装置中B、C之间长导管的作用是 , 浓硫酸的作用是;
(3)实验二中,完成水浴加热必需的玻璃仪器有、;
(4)实验一、二中当加入无水乙醇时,均有白雾产生,请简述产生白雾的原因:;
(5)经检验集气瓶C中无色液体为磷酸三乙酯,请在图中虚线框内画出实验装置(含试剂)用于验证生成的乙烯;
(6)根据实验现象判断以P2O5作为催化剂获得乙烯的反应条件是 .