题目内容
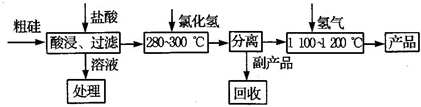
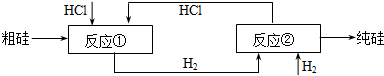
工业上用“三氯氢硅还原法”,提纯粗硅的工艺流程如图所示:
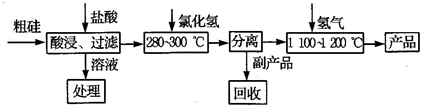
(1)三氯氢硅的制备原理:Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H=-210kJ/mol
工业上为了加快SiHCl的生成速率而又不降低硅的转化率,可以采用的方法是
(2)除上述反应外,还伴随着副反应:Si(s)+4HCl(g)?SiCl4(g)+2H2(g)△H=-241kJ/mol.已知:SiHCl、SiCl4常温下均为液体.
①工业上分离SiHCl、SiCl4的操作方法为
②反应SiHCl3(g)+HCl(g)?SiCl4(g)+H2(g)的△H=
(3)该生产工艺中可以循环使用的物质是

(1)三氯氢硅的制备原理:Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H=-210kJ/mol
工业上为了加快SiHCl的生成速率而又不降低硅的转化率,可以采用的方法是
升高温度或增大氢气与SiHCl3的物质的量之比或增大氢气浓度;
升高温度或增大氢气与SiHCl3的物质的量之比或增大氢气浓度;
.(2)除上述反应外,还伴随着副反应:Si(s)+4HCl(g)?SiCl4(g)+2H2(g)△H=-241kJ/mol.已知:SiHCl、SiCl4常温下均为液体.
①工业上分离SiHCl、SiCl4的操作方法为
蒸馏
蒸馏
.②反应SiHCl3(g)+HCl(g)?SiCl4(g)+H2(g)的△H=
-31
-31
kJ/mol.(3)该生产工艺中可以循环使用的物质是
氯化氢、氢气
氯化氢、氢气
(填物质名称).分析:(1)根据外界条件对平衡的影响;
(2)①根据互溶的液体采用蒸馏的方法分离;
②根据盖斯定律可以计算化学反应的焓变;
③根据化学根据反应物中和生成物中都有的物质考虑.
(2)①根据互溶的液体采用蒸馏的方法分离;
②根据盖斯定律可以计算化学反应的焓变;
③根据化学根据反应物中和生成物中都有的物质考虑.
解答:解:(1)升高温度或增大氢气与SiHCl3的物质的量之比或增大氢气浓度,提高还原时SiHCl3的转化率,
故答案为:升高温度或增大氢气与SiHCl3的物质的量之比或增大氢气浓度;
(2)①SiHCl3(l)和SiCl4(l)是互溶的液体,采用蒸馏的方法分离,故答案为:蒸馏;
②Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H=-210kJ/mol①
Si(s)+4HCl(g)?SiCl4(g)+2H2(g)△H=-241kJ/mol②
根据盖斯定律则②-①得:SiHCl3(g)+HCl(g)?SiCl4(g)+H2(g)△H=-31kJ/mol,故答案为:-31;
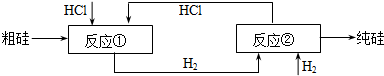
③由图示可知反应物有粗硅、HCl、H2;反应过程中生成物有:SiHCl3、H2、SiCl4、HCl,所以在反应物中和生成物中都有的物质是HCl、H2,所以流程中可循环使用的物质是HCl、H2,故答案为:氯化氢、氢气.
故答案为:升高温度或增大氢气与SiHCl3的物质的量之比或增大氢气浓度;
(2)①SiHCl3(l)和SiCl4(l)是互溶的液体,采用蒸馏的方法分离,故答案为:蒸馏;
②Si(s)+3HCl(g)?SiHCl3(g)+H2(g)△H=-210kJ/mol①
Si(s)+4HCl(g)?SiCl4(g)+2H2(g)△H=-241kJ/mol②
根据盖斯定律则②-①得:SiHCl3(g)+HCl(g)?SiCl4(g)+H2(g)△H=-31kJ/mol,故答案为:-31;
③由图示可知反应物有粗硅、HCl、H2;反应过程中生成物有:SiHCl3、H2、SiCl4、HCl,所以在反应物中和生成物中都有的物质是HCl、H2,所以流程中可循环使用的物质是HCl、H2,故答案为:氯化氢、氢气.
点评:本题结合提纯粗硅的工艺流程考查了外界条件对平衡的影响、物质的分离、盖斯定律的应用,难度较大,考查学生分析和解决问题的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
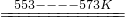 SiHCl3(l)+H2(g)
SiHCl3(l)+H2(g)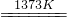 Si(纯)+3HCl
Si(纯)+3HCl