题目内容
物质在存在相似性的同时,还会存在某些性质上的递变性,下列说法正确的是( )
| A、HClO4、H2SO4、H3PO4的酸性逐渐增强 | B、乙醇、苯酚、乙酸电离出H+的能力由弱到强 | C、等质量的甲烷、乙烯、乙炔充分燃烧,消耗氧气的量由少到多 | D、物质的量浓度相等的NaCl、MgCl2、AlCl3三种溶液的pH由小到大 |
分析:A.非金属性越强,其最高价含氧酸的酸性越强;
B.酸性越强电离出H+的能力越强;
C.等质量的烃完全燃烧,氢元素的质量分数越大耗氧量越大;
D.盐中阳离子对应的碱越弱,水解程度越大,碱性越强.
B.酸性越强电离出H+的能力越强;
C.等质量的烃完全燃烧,氢元素的质量分数越大耗氧量越大;
D.盐中阳离子对应的碱越弱,水解程度越大,碱性越强.
解答:解:A.同周期,随原子序数增大非金属性增强,非金属性越强,其最高价含氧酸的酸性越强,故酸性HClO4、H2SO4、H3PO4的酸性逐渐减弱,故A错误;
B.乙醇呈中性,苯酚、乙酸都呈酸性,但乙酸具有酸的通性,酸性较强,苯酸性很弱,不能使指示剂变色,故乙醇、苯酚、乙酸电离出H+的能力增强,故B正确;
C.等质量的烃完全燃烧,氢元素的质量分数越大耗氧量越大,甲烷、乙烯、乙炔中氢元素的质量分数依次减小,故耗氧量由多到少,故C错误;
D.NaCl溶液呈中性、MgCl2、AlCl3为强酸弱碱盐,二者溶液呈酸性,由于碱性Mg(OH)2>Al(OH)3,故铝离子的水解程度大于镁离子,则AlCl3溶液酸性比MgCl2溶液强,故等物质的量浓度的NaCl、MgCl2、AlCl3三种溶液的pH由大到小,故D错误,
故选:B.
B.乙醇呈中性,苯酚、乙酸都呈酸性,但乙酸具有酸的通性,酸性较强,苯酸性很弱,不能使指示剂变色,故乙醇、苯酚、乙酸电离出H+的能力增强,故B正确;
C.等质量的烃完全燃烧,氢元素的质量分数越大耗氧量越大,甲烷、乙烯、乙炔中氢元素的质量分数依次减小,故耗氧量由多到少,故C错误;
D.NaCl溶液呈中性、MgCl2、AlCl3为强酸弱碱盐,二者溶液呈酸性,由于碱性Mg(OH)2>Al(OH)3,故铝离子的水解程度大于镁离子,则AlCl3溶液酸性比MgCl2溶液强,故等物质的量浓度的NaCl、MgCl2、AlCl3三种溶液的pH由大到小,故D错误,
故选:B.
点评:本题考查元素周期律、酸性强弱比较、烃耗氧量计算、盐类水解与溶液pH的判断等,题目难度不大,注意把握元素周期律,注意基础知识的理解掌握.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
物质间某些方面存在相似性的同时还存在某些性质的递变性,下列说法正确的是
| A.HClO4、H2SO4、H3PO4的酸性逐渐增强 |
| B.等质量的甲烷、乙烯、乙炔充分燃烧,消耗氧气的量由少到多 |
C.CH3CH2OH、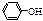 、CH3COOH电离出H+的能力由弱到强 、CH3COOH电离出H+的能力由弱到强 |
| D.物质的量浓度相等的NaCl、MgCl2、AlCl3三种溶液的pH由小到大 |
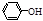 、CH3COOH电离出H+的能力由弱到强
、CH3COOH电离出H+的能力由弱到强