题目内容
【题目】下图均为实验过程中产生沉淀的物质的量(Y)与加入试剂的量(X)之间的关系图,其中正确的是
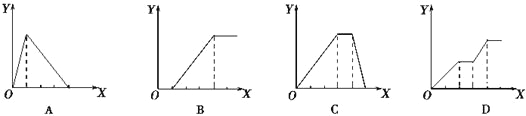
A. 图①:向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B. 图②:向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
C. 图③:向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量
D. 图④:向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量
【答案】C
【解析】试题分析:A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡,先产生氢氧化铝沉淀:AlCl3+3NaOH=Al(OH)3↓+3NaCl,继续滴加NaOH溶液,Al(OH)3和NaOH溶液反应,生成偏铝酸钠,沉淀溶解:NaOH+Al(OH)3=NaAlO2+2H2O,所以沉淀量达到最大消耗NaOH,和沉淀溶解消耗NaOH的比为3:1;故A错误;B.向NaAlO2溶液中滴加稀盐酸,开始阶段先产生氢氧化铝沉淀,发生反应:AlO2-+H++H2O=Al(OH)3↓,随着盐酸的逐滴加入,则沉淀开始溶解,发生反应:Al(OH)3+3H+=Al3++3H2O,所以沉淀量达到最大消耗的盐酸和沉淀完全溶解消耗的盐酸的物质的量之比是1:3.故B错误;C.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液,开始滴加NaOH发生反应为Al3++3OH-=Al(OH)3↓,先产生氢氧化铝沉淀,当Al3+沉淀完全后,然后发生反应NH4++OH-=NH3H2O;NH4+,此时沉淀氢氧化铝的量不变,最后继续滴加NaOH,发生反应Al(OH)3+OH-=AlO2-+2H2O,氢氧化铝沉淀溶解,沉淀量达到最大消耗NaOH,沉淀量不变和沉淀溶解消耗NaOH的比为3:1:1;故C正确;D.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量,先发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,产生沉淀,然后发生反应:CO2+2NaOH=Na2CO3+H2O,此时沉淀的量不变,再发生反应2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,产生沉淀,又发生反应:CO32-+H2O+CO2=2HCO3-,BaCO3+H2O+CO2=Ba(HCO3)2故图象错误.CO32-+H2O+CO2=2HCO3-,BaCO3+H2O+CO2=Ba(HCO3)2故图象错误.Na2CO3+H2O+CO2=2NaHCO3沉淀量不变,最后发生反应:BaCO3+2H2O+2CO2=Ba(HCO3)2,沉淀部分溶解,故D错误;故选C。