��Ŀ����
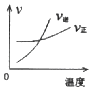
����Ŀ��Ϊ̽���������ܽ��ԣ�ij��ȤС�鰴��ͼ��ʾװ�ý���ʵ��(fΪֹˮ��)����ش��������⣺

��1��д��ʵ������ȡ�����Ļ�ѧ����ʽ____________________��
��2��Ҫ�õ�����İ�����ѡ��________������ĸ�����������
A����ʯ�� B��Ũ���� C��Ũ���� D������������Һ
��3������ͼװ�ý�����Ȫʵ�飬��ƿ����װ�����ﰱ��(��״��)������ˮ������IJ�����__________��ʵ���ԭ����_____________��
��4�����״���£�����ʵ�����ƿ�����ʵ����ʵ���Ũ����________mol��L��1��
���𰸡� 2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O A ��ֹˮ��f��������ͷ�ι��е�Һ�壬������ҡ�� ��ƿ������������ˮ����ʹ��ƿ������ѹǿѸ�ټ�С
CaCl2��2NH3����2H2O A ��ֹˮ��f��������ͷ�ι��е�Һ�壬������ҡ�� ��ƿ������������ˮ����ʹ��ƿ������ѹǿѸ�ټ�С ![]()
����������1���ڼ��������£��Ȼ�狀��������Ʒ�Ӧ�����Ȼ��ơ�ˮ�Ͱ�������Ӧ����ʽ��2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O
CaCl2��2NH3����2H2O
�ʴ�Ϊ��2NH4Cl��Ca(OH)2![]() CaCl2��2NH3����2H2O��
CaCl2��2NH3����2H2O��
��2��Ũ�����Ũ����������ԣ������Ǽ������壬���ԣ�Ũ�����Ũ���ᶼ���ܸ��ﰱ����������������ˮ����������������Һ���ܸ������壬�ʴ�Ϊ��A��
��3��������һ�ּ�������ˮ�����壬����ͷ�ι��е�ˮ������ƿ�У�ƿ��ѹǿ��С���������ѹ�������£�ˮ��ѹ��ƿ�ڣ��γ���Ȫ���ʴ�Ϊ����ֹˮ��f��������ͷ�ι��е�Һ�壬������ҡ����ƿ����ֹˮ�С�
��4������ƿ�����ΪVL,���״���£����ʵ���ΪVL/22.4L.mol-1����ʵ�����ƿ�����ʵ����ʵ���Ũ����1/22.4mol��L��1,�𰸣�1/22.4��