题目内容
在标准状况下,将质量为相同状况下同体积氢气质量16倍的CO2和CO的混合气体,充满盛有Na2O2且容积为2.24 L的密闭容器中(假设固体的体积忽略不计),用间断发生的电火花引发反应,使可能发生的反应充分进行。试完成下列问题:
(1)反应前充入容器中的CO2和CO的物质的量各是多少?
(2)最后容器中的生成物有哪些?其质量各是多少?
(1)反应前充入容器中的CO2和CO的物质的量各是多少?
(2)最后容器中的生成物有哪些?其质量各是多少?
(1)n(CO2)="0.025" mol,n(CO)="0.075" mol
(2)生成物为Na2CO3和O2;其中Na2CO3为10.6 g, O2为0.4 g。
(2)生成物为Na2CO3和O2;其中Na2CO3为10.6 g, O2为0.4 g。
由题意知混合气体的平均相对分子质量为16×2=32,
 =
= ,故n(CO2)=
,故n(CO2)=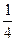 ×0.1 mol="0.025" mol,n(CO)="0.075" mol,又因:2CO2+2Na2O2====2Na2CO3+O2,2CO+O2
×0.1 mol="0.025" mol,n(CO)="0.075" mol,又因:2CO2+2Na2O2====2Na2CO3+O2,2CO+O2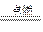 2CO2,可看作按CO+Na2O2====Na2CO3和2CO2+2Na2O2====2Na2CO3+O2两反应进行,CO完全消耗掉,生成的O2可由CO2与Na2O2的反应求得,故由C原子守恒知:生成Na2CO3为0.1 mol,产生O2共0.025 mol×
2CO2,可看作按CO+Na2O2====Na2CO3和2CO2+2Na2O2====2Na2CO3+O2两反应进行,CO完全消耗掉,生成的O2可由CO2与Na2O2的反应求得,故由C原子守恒知:生成Na2CO3为0.1 mol,产生O2共0.025 mol×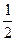 ="0.012" 5 mol。
="0.012" 5 mol。
 =
= ,故n(CO2)=
,故n(CO2)=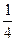 ×0.1 mol="0.025" mol,n(CO)="0.075" mol,又因:2CO2+2Na2O2====2Na2CO3+O2,2CO+O2
×0.1 mol="0.025" mol,n(CO)="0.075" mol,又因:2CO2+2Na2O2====2Na2CO3+O2,2CO+O2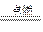 2CO2,可看作按CO+Na2O2====Na2CO3和2CO2+2Na2O2====2Na2CO3+O2两反应进行,CO完全消耗掉,生成的O2可由CO2与Na2O2的反应求得,故由C原子守恒知:生成Na2CO3为0.1 mol,产生O2共0.025 mol×
2CO2,可看作按CO+Na2O2====Na2CO3和2CO2+2Na2O2====2Na2CO3+O2两反应进行,CO完全消耗掉,生成的O2可由CO2与Na2O2的反应求得,故由C原子守恒知:生成Na2CO3为0.1 mol,产生O2共0.025 mol×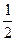 ="0.012" 5 mol。
="0.012" 5 mol。
练习册系列答案
相关题目
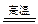 Na2SiO3+CO2↑可知硅酸的酸性比碳酸的酸性强
Na2SiO3+CO2↑可知硅酸的酸性比碳酸的酸性强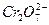 和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为( )
和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为( )