题目内容
【题目】FeCl3,学名三氯化铁,是黑棕色结晶,主要用于金属蚀刻,污水处理等。解答下列问题。
(1)按照物质的分类方法,FeCl3应属于_________。
①酸 ②氯化物 ③混合物 ④盐 ⑤化合物 ⑥电解质 ⑦易溶物
A.②③④⑤⑥⑦ B.①④⑥⑦ C.②④⑤⑥⑦ D.④⑤⑥⑦
(2)0.1mol/LFeCl3溶液中c(Cl-)=_____mol/L。测得200mL某浓度FeCl3溶液中Cl-的质量为21.3g,则此溶液中c(Fe3+) =____________mol/L.
(3)将50mL 0.1mol/L FeCl3和50mL 0.5mol/L CaCl2混合后,其溶液的体积变为二者的体积之和,则混合液中Cl-的物质的量浓度为_____mol/L.
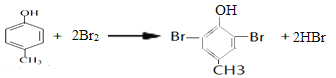
(4)芳香族化合物A的分子式为C7H8O,A中加入FeCl3溶液显紫色,且苯环上的一氯代物只有二种,A的结构简式为________,写出A与浓溴水反应的方程式________。
(5)FeCl3可制备氢氧化铁胶体处理污水,处理污水时发生了__________(物理或化学)变化。
【答案】C 0.3 1 0.65 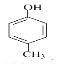
 化学变化
化学变化
【解析】
(1)①氯化铁电离出的阳离子是铁离子,属于盐,不是酸,①错误;
②氯化铁由铁和氯两种元素组成,属于氯化物,②正确;
③氯化铁由一种物质组成,属于纯净物,不是混合物,③错误;
④氯化铁在水溶液中可以电离出铁离子和氯离子,故其属于盐,④正确;
⑤氯化铁由铁和氯两种元素组成,属于化合物,⑤正确;
⑥氯化铁溶于水电离出阴阳离子,属于电解质,⑥正确;
⑦氯化铁易溶于水,属于易溶物,⑦正确。
答案选C。
(2)根据化学式可知0.1mol/LFeCl3溶液中c(Cl-)=0.1mol/L×3=0.3mol/L。测得200mL某浓度FeCl3溶液中Cl-的质量为21.3g,物质的量是21.3g÷35.5g/mol=0.6mol,则此溶液中铁离子的物质的量是0.2mol,其浓度为c(Fe3+)=0.2mol÷0.2L=1.0mol/L;
(3)将50mL0.1mol/LFeCl3和50mL0.5mol/LCaCl2混合后,其溶液的体积变为二者的体积之和,则混合液中Cl-的物质的量浓度为![]() ;
;
(4)芳香族化合物A的分子式为C7H8O,A中加入FeCl3溶液显紫色,含有酚羟基,且苯环上的一氯代物只有二种,说明含有的取代基即甲基和酚羟基处于对位,则A的结构简式为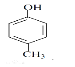 ,A与浓溴水反应的方程式为
,A与浓溴水反应的方程式为 ;
;
(5)FeCl3溶于水电离出的铁离子水解生成氢氧化铁胶体,胶体具有吸附性,因此处理污水时发生了化学变化。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案