题目内容
下列物质中既能跟氢氧化钠溶液反应, 又能跟稀盐酸反应的是
①Al2O3 ②Al(OH)3 ③(NH4)2CO3 ④NaHCO3 ⑤BaCl2
| A.③④⑤ | B.②③④⑤ | C.①②③④ | D.全部 |
C
解析试题分析:①Al2O3+6HCl=2AlCl3+3H2O, Al2O3+2NaOH=2NaAlO2+2H2O.正确。②Al(OH)3+3HCl=AlCl3+3H2O, Al(OH)3+NaOH=NaAlO2+2H2O。正确。④NaHCO3+HCl=NaCl+H2O+ CO2↑,NaHCO3+NaOH= Na2CO3+ H2O.正确。⑤BaCl2跟氢氧化钠及稀盐酸都不能发生反应。错误。
考点:考查Al2O3、Al(OH)3、(NH4)2CO、NaHCO3等的化学性质。

 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案下列说法不合理的是
| A.FeCl3、Na2O2、CuS均可由相应单质直接化合生成 |
| B.在稀硫酸中加入铜粉,铜粉不溶解,若加入KNO3固体,铜粉溶解 |
| C.“溶洞’’的形成过程中发生了碳酸钙与水、CO2的反应 |
| D.氢氧化铝、碳酸铵都既能与盐酸反应,又能与氢氧化钠溶液反应 |
如图所示的甲、乙、丙三种物质均含有相同的某种元素,箭头表示物质间的转化一步就能实现,则甲可能是
①Fe;②HNO3;③Na;④C
| A.①②③ | B.②③④ | C.①②④ | D.①②③④ |
下列说法不正确的是
| A.常温下浓硝酸能使铁、铝发生钝化 |
| B.碳酸钠的热稳定性比碳酸氢钠的强 |
| C.铜粉与稀硫酸不反应,但加入一定量硝酸钠后铜粉溶解 |
| D.加入氯化钡溶液产生白色沉淀,则溶液中一定含有SO42- |
丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颜色变化的叙述中,正确的是
①新制氯水久置后→浅黄绿色消失
②淀粉溶液遇碘化钾→蓝色
③蔗糖中加入浓硫酸搅拌→白色
④SO2通入品红溶液中→红色褪去
⑤氨气通入酚酞溶液中→红色
| A.①②④⑤ | B.②③④⑤ | C.①④⑤ | D.①②③④⑤ |
下列物质间的每步转化都能通过一步反应实现的是
①Fe→Fe2O3→Fe(OH)3 ②Na→Na2O2→Na2CO3
③S→SO3→H2SO4→MgSO4 ④C→CO→CO2→Na2CO3
| A.①② | B.③④ | C.②④ | D.①③ |
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是
| A.加热时,①上部汇聚了固体碘,说明碘的热稳定性较差 |
| B.加热时,②、③中的溶液均变红,冷却后又都变为无色 |
| C.④中,浸泡在热水中的容器内气体颜色变深,浸泡在冰水中的容器内气体颜色变浅 |
| D.四个“封管实验”中都有可逆反应发生 |
化学美无处不在,下图是物质间发生化学反应的颜色变化,其中X是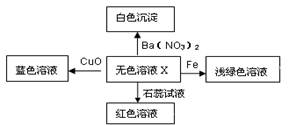
| A.稀盐酸 | B.稀硫酸 | C.硫酸钠溶液 | D.碳酸钠溶液 |
下列有关实验操作、实验现象和结论都正确的是 ( )。
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 在Ba(NO3)2溶液中分别滴入H2SO3和H2SO4溶液 | 均有白色沉淀 | 沉淀均为BaSO4 |
| B | 混合装有Cl2和NH3两集气瓶中的气体 | 产生大量白烟 | NH3显还原性和碱性 |
| C | 溶液X中滴入盐酸酸化的FeCl3溶液,再滴入淀粉溶液 | 溶液变蓝色 | 溶液X中一定含有I- |
| D | 向浓度均为0.01 mol·L-1的NaCl和Na2S的混合溶液中滴入少量AgNO3溶液 | 出现黑色沉淀 | Ksp(Ag2S)> Ksp(AgCl) |