题目内容
1.下列说法正确的是( )| A. | 56 g Fe在标准状况下所占的体积约为22.4 L | |
| B. | 22.4 L N2 含阿伏加德罗常数个 N2 分子 | |
| C. | 在标准状况下,22.4 L H2O 的质量约为 18 g | |
| D. | 22 g CO2 与标准状况下11.2 L H2含有相同分子数 |
分析 A.56gFe的物质的量为1mol,标况下Fe是固体;
B.温度、压强不确定,氮气不一定处于标况下;
C.标况下水不是气体;
D.根据n=$\frac{m}{M}$计算二氧化碳物质的量,根据n=$\frac{V}{{V}_{m}}$计算氢气物质的量.
解答 解:A.56gFe的物质的量为1mol,标况下Fe是固体,其体积远远小于22.4L,故A错误;
B.温度、压强不确定,氮气不一定处于标况下,22.4 L N2 的物质的量不一定是1mol,则不一定含有阿伏加德罗常数个 N2 分子,故B错误;
C.标况下水不是气体,22.4L水的物质的量不是1mol,其质量远远大于18g,故C错误;
D.22 g CO2 的物质的量为$\frac{22g}{44g/mol}$=0.5mol,标准状况下11.2 L H2的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,二者含有相同分子数,故D正确,
故选:D.
点评 本题考查气体摩尔体积、物质的量计算,难度不大,注意气体摩尔体积的使用对象与条件,根据PV=nRT理解温度、压强为气体摩尔体积的影响.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
11.在其他条件不变时,下列说法中正确的是( )
| A. | 升高温度,活化分子百分数增加,化学反应速率一定增大 | |
| B. | 增大压强,可使活化分子百分数增多,化学反应速率一定增大 | |
| C. | 加入反应物可使活化分子百分数大大增加,化学反应速率大大加快 | |
| D. | 活化分子间所发生的碰撞均为有效碰撞 |
12.为了证明硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]中含有NH4+、Fe2+、SO42-和H2O,下列实验叙述中不正确的是( )
| A. | 取少量晶体放入试管中,加热,若试管口上蘸有少量无水硫酸铜粉末的脱脂棉变蓝,则可证明晶体中含有结晶水 | |
| B. | 取少量晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+ | |
| C. | 取少量晶体放入试管,加入少量稀NaOH溶液,在试管口用湿润的蓝色石蕊试纸检验,若变红,则可证明晶体的成分中含有NH4+ | |
| D. | 取少量晶体溶于水,加适量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SO42- |
10.下列叙述正确的是( )
| A. | H2与T2互为同位素 | B. | SO2、CO均属于酸性氧化物 | ||
| C. | 离子化合物中一定不含共价键 | D. | 氯化铵、氯化氢都属于强电解质 |
11.原子序数依次增大的短周期主族元素X、Y、Z、W,X是最外层只有一个电子的非金属元素,Y是地壳中含量最高的元素,W的原子序数是Y的2倍,X、Y、Z、W最外层电子数之和为15.下列说法正确的是( )
| A. | X和Y只能形成一种化合物 | B. | 简单离子半径:W2->Y2->Z2+ | ||
| C. | 简单气态氢化物的热稳定性:W>Y | D. | WY2、ZY中化学键类型相同 |
 的名称为3,3,4-三甲基己烷
的名称为3,3,4-三甲基己烷 的名称为3-甲基-1-戊烯
的名称为3-甲基-1-戊烯
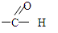 .
.