题目内容
【题目】
汽车尾气中的氮氧化物气体是导致雾霾的要原因之一。请回答下列有关尾气治理的问题:
(1)用化学方程式解释汽车尾气中含有NO的原因_______________________________。
(2)汽车排气管内安装的催化转化器,可使汽车尾气中的主要污染物NO、CO转化为无毒的大气循环物质。
已知:N2(g)+O2(g)=2NO(g) △H=+180.5kJmol-1
2C(s)+O2(g)=2CO(g) △H= -221.0kJmol-1
C(s)+O2(g)=CO2(g) △H= -393.5 kJmol-1
则分析反应2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H= ___________kJmol-1。
(3)将0.20mol NO和0.10molCO充入一个容积恒定为1L的密闭容器中,在不同条件下反应过程中部分物质的浓度变化状况如图1所示。
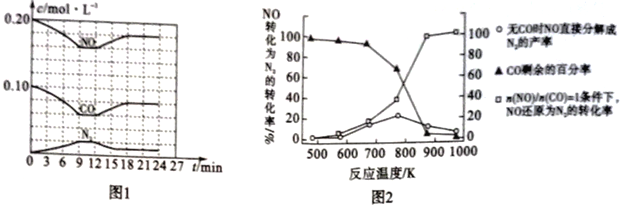
①计算反应在第9-12 min时的平衡常数K=____________。
②第12 min时改变的反应条件可能是_____________(任写一条)。
(4)某研究机构在实验室以Ag-ZSM-5为催化剂。测得单位时间内NO转化为N2的转化率随温度变化情况如图2所示。
①若不使用CO,发现当温度超过775 K时,NO的分解率降低,其可能的原因是________________。
②在n(NO)/n(CO) =1的条件下,为更好地除去NO,应控制的最佳温度应在____ K左右。
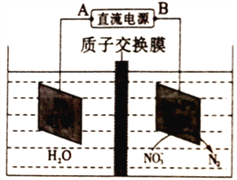
(5)氮氧化物进入水体可转化为NO3-,电化学降解法可用于治理水中NO3-的污染,原理如右图所示。则电源正极为______(选填“A”或“B”),阴极电极反应式为__________________。
【答案】 N2 + O2 ![]() 2NO —746.5 0.35(或
2NO —746.5 0.35(或![]() ) 温度升高 NO的分解反应是放热反应,升高温度不利于反应进行 870K(只要在850-900K均可) A 2NO3-+10e-+12H+==N2↑+6H2O
) 温度升高 NO的分解反应是放热反应,升高温度不利于反应进行 870K(只要在850-900K均可) A 2NO3-+10e-+12H+==N2↑+6H2O
【解析】试题分析:(1)氮气与氧气在高温、放电条件下生成NO;(2)根据盖斯定律计算2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H;(3)①根据![]() 计算9-12 min时的平衡常数;②根据图1,第12 min时NO、CO浓度增大、N2浓度减小,平衡逆向移动;(4)①NO的分解反应是放热反应,升高温度不利于反应进行;②n(NO)/n(CO) =1的条件下,850-900K时NO转化为N2的转化率几乎达到100%;(5)根据图示,右池中NO3-发生还原反应生成氮气,所以右池是阴极,阴极NO3-得电子生成氮气;
计算9-12 min时的平衡常数;②根据图1,第12 min时NO、CO浓度增大、N2浓度减小,平衡逆向移动;(4)①NO的分解反应是放热反应,升高温度不利于反应进行;②n(NO)/n(CO) =1的条件下,850-900K时NO转化为N2的转化率几乎达到100%;(5)根据图示,右池中NO3-发生还原反应生成氮气,所以右池是阴极,阴极NO3-得电子生成氮气;
解析:(1)氮气与氧气在高温、放电条件下生成NO,反应方程式是N2 + O2 ![]() 2NO;(2)①N2(g)+O2(g)=2NO(g) △H=+180.5kJmol-1;②2C(s)+O2(g)=2CO (g) △H= -221.0kJmol-1;③C(s)+O2(g)=CO2(g) △H= -393.5 kJmol-1,根据盖斯定律③×2-①-②得2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H= —746.5 kJmol-1;(3)①9-12 min时c(NO)=0.16mol/L、c(CO)=0.06 mol/L、c(N2)=0.02 mol/L、c(CO2)=0.04 mol/L,
2NO;(2)①N2(g)+O2(g)=2NO(g) △H=+180.5kJmol-1;②2C(s)+O2(g)=2CO (g) △H= -221.0kJmol-1;③C(s)+O2(g)=CO2(g) △H= -393.5 kJmol-1,根据盖斯定律③×2-①-②得2NO(g)+2CO(g)=N2(g)+2CO2(g)的△H= —746.5 kJmol-1;(3)①9-12 min时c(NO)=0.16mol/L、c(CO)=0.06 mol/L、c(N2)=0.02 mol/L、c(CO2)=0.04 mol/L,![]() 0.35;②根据图1,第12 min时NO、CO浓度增大、N2浓度减小,平衡逆向移动,所以改变的条件可能是升高温度;(4)①NO的分解反应是放热反应,升高温度不利于反应进行,所以当温度超过775 K时,NO的分解率降低;②n(NO)/n(CO) =1的条件下,850-900K时NO转化为N2的转化率几乎达到100%,为更好地除去NO,应控制的最佳温度应在870K左右;(5)根据图示,右池中NO3-发生还原反应生成氮气,所以右池是阴极,B是电源负极、A是电源正极,阴极NO3-得电子生成氮气,电极反应为2NO3-+10e-+12H+==N2↑+6H2O;
0.35;②根据图1,第12 min时NO、CO浓度增大、N2浓度减小,平衡逆向移动,所以改变的条件可能是升高温度;(4)①NO的分解反应是放热反应,升高温度不利于反应进行,所以当温度超过775 K时,NO的分解率降低;②n(NO)/n(CO) =1的条件下,850-900K时NO转化为N2的转化率几乎达到100%,为更好地除去NO,应控制的最佳温度应在870K左右;(5)根据图示,右池中NO3-发生还原反应生成氮气,所以右池是阴极,B是电源负极、A是电源正极,阴极NO3-得电子生成氮气,电极反应为2NO3-+10e-+12H+==N2↑+6H2O;