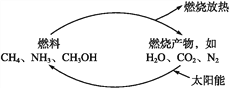
题目内容
【题目】A、B是短周期元素,最外层电子排布式分别为3s2,2s22p3。A与B形成的离子化合物加蒸馏水溶解后可使酚酞试液变红,同时有气体逸出,该气体可使湿润的红色石蕊试纸变蓝,则该化合物的分子量是
A. 38 B. 55 C. 100 D. 135
【答案】C
【解析】
A、B是短周期元素,最外层电子排布式分别为3s2、2s22p3,则A是Mg,B是N。A与B形成的离子化合物是氮化镁,与水反应生成氢氧化镁和氨气,氨气可使湿润的红色石蕊试纸变蓝。氮化镁的化学式为Mg3N2,则该化合物的分子量是24×3+14×2=100。答案选C。

练习册系列答案
相关题目
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D