题目内容
课外化学兴趣小组欲测定铜锌合金粉末中锌的质量分数.
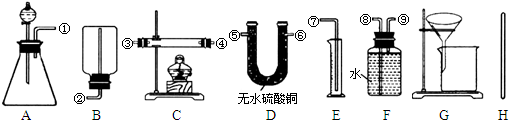
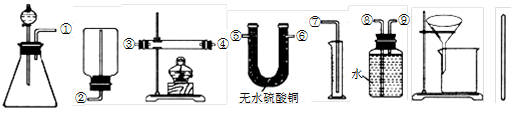
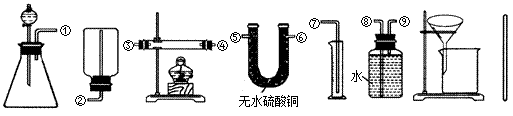
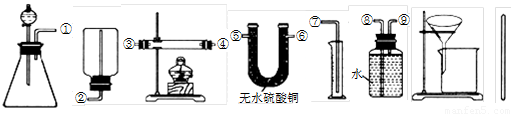
Ⅰ.除托盘天平必用外,供选择的实验装置如下: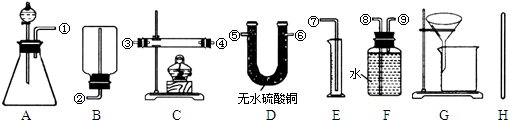
Ⅱ.实验中可测得的数据及其代号如下:
样品的质量m1;充分反应生成的气体体积V(标准状况);反应前仪器和药品的总质量m2;充分反应后仪器和药品的总质量m3;充分反应后剩余固体的质量m4.
(1)实验时必须用到的化学试剂为______.
(2)甲同学实验中使用了A、E、F三种装置,组装时接口编号的连接顺序为:______.样品中锌的质量分数的计算式为______.
(3)乙同学实验中测得的数据为m1和m4,他使用的实验装置有______(填字母).
(4)丙同学实验中只选用了A装置,他要测得的数据有______(填代号).
(5)丁同学设计了另一种测定方法,他考虑使用A、C、D三种装置,在C装置中添加足量CuO.除测定m1外,还准备测定C装置反应前后的质量变化.请评价该方法是否可行并说明理由:______.
解:(1)要想分离铜和锌,只能根据两种金属的活泼性不同,使活泼金属和酸反应,另一种金属和酸不反应,不仅能将两种金属分开,还能根据反应计算锌的质量,则实验时必须用到的化学试剂为稀硫酸,
故答案为:稀硫酸;
(2)根据发生装置、排水装置、收集装置进行排序,且排水装置中短管进气长管排水,所以其排列顺序为:①⑨⑧⑦,根据氢气的体积可以得到锌的质量,再根据质量分数公式得锌的质量分数=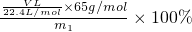 =
=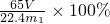 ,故答案为:①⑨⑧⑦,
,故答案为:①⑨⑧⑦,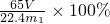 ;
;
(3)乙同学实验中测得的数据为m1和m4,说明乙同学能得到反应后的固体质量,要想得到反应后的固体必须采用过滤的方法制取,过滤过程中要用玻璃棒引流,所以他使用的实验装置有AGH,
故答案为:AGH;
(4)丙同学实验中只选用了A装置,说明他只能知道A装置反应前后的质量和样品的质量,他要测得的数据有
m1、m2、m3,故答案为:m1、m2、m3;
(5)用氢气还原氧化铜时,首先要通氢排除装置中的氧气,反应后还要通氢防止铜被氧化,所以导致氢气的量测量不准,则无法计算锌的质量,所以不可行,
故答案为:不可行;因为氢气还原氧化铜时,排除装置中的空气及冷却装置都要消耗氢气,而且部分氢气未反应即排出,所以不可能通过计算得出氢气的产量,也无法计算锌的质量.
分析:(1)要使锌发生反应生成氢气,则实验时必须用到的化学试剂是稀硫酸;
(2)根据发生装置、排水装置、收集装置进行排序;根据氢气的体积计算锌的质量,再根据质量分数公式计算锌的质量分数;
(3)乙同学实验中测得的数据为m1和m4,说明乙同学能得到反应后的固体质量;
(4)丙同学实验中只选用了A装置,要想得到锌的质量,必须知道样品质量、反应前仪器和药品的总质量、充分反应后仪器和药品的总质量;
(5)氢气不能完全和氧化铜反应,导致氢气的量不准确.
点评:本题考查了探究物质的组成或含量的测定,明确测量原理是解本题关键,知道氢气还原氧化铜的操作步骤,难度较大.
故答案为:稀硫酸;
(2)根据发生装置、排水装置、收集装置进行排序,且排水装置中短管进气长管排水,所以其排列顺序为:①⑨⑧⑦,根据氢气的体积可以得到锌的质量,再根据质量分数公式得锌的质量分数=
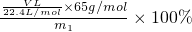 =
=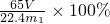 ,故答案为:①⑨⑧⑦,
,故答案为:①⑨⑧⑦,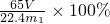 ;
;(3)乙同学实验中测得的数据为m1和m4,说明乙同学能得到反应后的固体质量,要想得到反应后的固体必须采用过滤的方法制取,过滤过程中要用玻璃棒引流,所以他使用的实验装置有AGH,
故答案为:AGH;
(4)丙同学实验中只选用了A装置,说明他只能知道A装置反应前后的质量和样品的质量,他要测得的数据有
m1、m2、m3,故答案为:m1、m2、m3;
(5)用氢气还原氧化铜时,首先要通氢排除装置中的氧气,反应后还要通氢防止铜被氧化,所以导致氢气的量测量不准,则无法计算锌的质量,所以不可行,
故答案为:不可行;因为氢气还原氧化铜时,排除装置中的空气及冷却装置都要消耗氢气,而且部分氢气未反应即排出,所以不可能通过计算得出氢气的产量,也无法计算锌的质量.
分析:(1)要使锌发生反应生成氢气,则实验时必须用到的化学试剂是稀硫酸;
(2)根据发生装置、排水装置、收集装置进行排序;根据氢气的体积计算锌的质量,再根据质量分数公式计算锌的质量分数;
(3)乙同学实验中测得的数据为m1和m4,说明乙同学能得到反应后的固体质量;
(4)丙同学实验中只选用了A装置,要想得到锌的质量,必须知道样品质量、反应前仪器和药品的总质量、充分反应后仪器和药品的总质量;
(5)氢气不能完全和氧化铜反应,导致氢气的量不准确.
点评:本题考查了探究物质的组成或含量的测定,明确测量原理是解本题关键,知道氢气还原氧化铜的操作步骤,难度较大.

练习册系列答案
相关题目