题目内容
A、B、C、D、G 都是含有同一种短周期元素的化合物,E是氧化物,H是单质,D是常见的强酸,反应①、②、③是工业生产中的重要反应,根据图转化关系(反应条件及部分产物已略去)填空: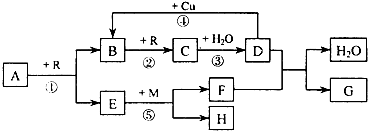
(1)若A、B、C、D、G 均含X 元素,且A 的一个分子中只含有10 个电子,G 是复合肥料,则反应①、②、③是工业生产 的基本原理,M 的化学式是 .反应④的离子方程式是 .
(2)若A、B、C、D、G均含Y元素,Y 元素处于X的相邻周期、相邻族,A为黄色固体,G可作净水剂,则M元素在周期表中的位置是 .其中反应①的化学方程式是 ;将2.5t含85%A的矿石(杂质不参加反应)煅烧时,A中的Y元素有5.0%损失而混入炉渣,计算可制得98%的D的质量 t.

(1)若A、B、C、D、G 均含X 元素,且A 的一个分子中只含有10 个电子,G 是复合肥料,则反应①、②、③是工业生产
(2)若A、B、C、D、G均含Y元素,Y 元素处于X的相邻周期、相邻族,A为黄色固体,G可作净水剂,则M元素在周期表中的位置是
分析:D是常见的强酸,能与Cu反应生成B,则D为硝酸或硫酸,由B与R反应生成C、C与水反应生成酸D,在B为NO或SO2,可推知R为O2,
(1)A的一个分子中只含有10个电子且能连续氧化,则A为NH3,B是NO,E是H2O,C是NO2,D是HNO3;由于G是复合肥料,只能是KNO3,由M与水反应生成F与单质H,故F为KOH,H为H2,M为K;
(2)Y元素处于N元素的相邻周期、相邻族,说明Y是S元素,故B为SO2,C为SO3,D为H2SO4,A为黄色固体,反应①是工业生产硫酸的反应,可推知A为FeS2、E为Fe2O3,G可作净水剂,G为Al2(SO4)3,由M与Fe2O3反应生成F与单质H,应为铝热反应,可推知M为Al、H为Fe、F为Al2O3,据此解答.
(1)A的一个分子中只含有10个电子且能连续氧化,则A为NH3,B是NO,E是H2O,C是NO2,D是HNO3;由于G是复合肥料,只能是KNO3,由M与水反应生成F与单质H,故F为KOH,H为H2,M为K;
(2)Y元素处于N元素的相邻周期、相邻族,说明Y是S元素,故B为SO2,C为SO3,D为H2SO4,A为黄色固体,反应①是工业生产硫酸的反应,可推知A为FeS2、E为Fe2O3,G可作净水剂,G为Al2(SO4)3,由M与Fe2O3反应生成F与单质H,应为铝热反应,可推知M为Al、H为Fe、F为Al2O3,据此解答.
解答:解:D是常见的强酸,能与Cu反应生成B,则D为硝酸或硫酸,由B与R反应生成C、C与水反应生成酸D,在B为NO或SO2,可推知R为O2,
(1)A的一个分子中只含有10个电子且能连续氧化,则A为NH3,B是NO,E是H2O,C是NO2,D是HNO3;由于G是复合肥料,只能是KNO3,由M与水反应生成F与单质H,故F为KOH、H为H2、M为K,则:
反应①、②、③是工业生产硝酸的重要反应,反应④是铜和稀硝酸的反应,其离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:硝酸;K;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)Y元素处于N元素的相邻周期、相邻族,说明Y是S元素,故B为SO2,C为SO3,D为H2SO4,A为黄色固体,反应①是工业生产硫酸的反应,可推知A为FeS2、E为Fe2O3,G可作净水剂,G为Al2(SO4)3,由M与Fe2O3反应生成F与单质H,应为铝热反应,可推知M为Al、H为Fe、F为Al2O3,则:Al位于第三周期ⅢA族,反应①的化学方程式是:4FeS2+11O2
2Fe2O3+8SO2,
令生成硫酸xt,则:
FeS2~~~~~~~2H2SO4
120 2×98
2.5t×85%×(1-5.0%) xt×98%
所以,120:2×98=2.5t×85%×(1-5.0%):xt×98%,解得x=3.4,
故答案为:第三周期ⅢA族;4FeS2+11O2
2Fe2O3+8SO2;3.4t.
(1)A的一个分子中只含有10个电子且能连续氧化,则A为NH3,B是NO,E是H2O,C是NO2,D是HNO3;由于G是复合肥料,只能是KNO3,由M与水反应生成F与单质H,故F为KOH、H为H2、M为K,则:
反应①、②、③是工业生产硝酸的重要反应,反应④是铜和稀硝酸的反应,其离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:硝酸;K;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(2)Y元素处于N元素的相邻周期、相邻族,说明Y是S元素,故B为SO2,C为SO3,D为H2SO4,A为黄色固体,反应①是工业生产硫酸的反应,可推知A为FeS2、E为Fe2O3,G可作净水剂,G为Al2(SO4)3,由M与Fe2O3反应生成F与单质H,应为铝热反应,可推知M为Al、H为Fe、F为Al2O3,则:Al位于第三周期ⅢA族,反应①的化学方程式是:4FeS2+11O2
| ||
令生成硫酸xt,则:
FeS2~~~~~~~2H2SO4
120 2×98
2.5t×85%×(1-5.0%) xt×98%
所以,120:2×98=2.5t×85%×(1-5.0%):xt×98%,解得x=3.4,
故答案为:第三周期ⅢA族;4FeS2+11O2
| ||
点评:本题考查N和S元素的化合物的推断题,注意浓硫酸、硝酸与铜的反应为推断的突破口,(2)中注意根据关系式进行计算,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体.化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去.试回答下列问题:
如图所示,A、B、C、D、G是五种常见单质,其中A、G为气体.化合物R在常温下呈液态,F为黑色晶体,H为淡黄色粉末,I是玻璃工业的一种原料,图中部分生成物已略去.试回答下列问题:
 某学生利用物质间的互变,设计成一个平面魔方,如图所示:
某学生利用物质间的互变,设计成一个平面魔方,如图所示: