题目内容
【题目】下列对相关方程式书写判定及解释正确的是
选项 | 离子方程式 | 评价 |
A | 将2molCl2通入到含1molFeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确:Cl2过量,可将Fe2+、I-均氧化 |
B | 工业上制铝:2AlCl3 | 正确:阳极氯离子放电,阴极铝粒子放电 |
C | 向AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O= AlO2-+4NH4++2H2O | 正确:氨水过量,氢氧化铝能溶于过量的碱 |
D | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=Fe3++4H2O | 错误:等式两侧电荷不守恒,生成物中应有亚铁离子 |
A. A B. B C. C D. D
【答案】D
【解析】A.将2molCl2通入到含1mol FeI2的溶液中,由电离守恒可知,氯气过量,则离子反应为2Fe2++4I-+3Cl2= 2Fe3++6Cl-+2I2,错误;B.氯化铝为共价化合物,熔融状态不能导电,工业上采用电解氧化铝的方法制铝,错误;C.氢氧化铝只能溶于强碱,一水合氨是弱碱,则向AlCl3溶液中加入过量的浓氨水的离子方程式为Al3++3NH3·H2O![]() A1(OH)3↓+3NH4+ ,错误;D.将磁性氧化铁溶于盐酸的离子反应为:Fe3O4+8H+═2Fe3++Fe2++4H2O,正确。
A1(OH)3↓+3NH4+ ,错误;D.将磁性氧化铁溶于盐酸的离子反应为:Fe3O4+8H+═2Fe3++Fe2++4H2O,正确。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第________周期,第______族;
(2)X可形成双原子分子,其分子的电子式是_________;Y和氢元素形成的10电子微粒中常见+1价阳离子为_______(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式__________。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式_________________________。
(4)将0.20molYZ2和0.10molO2充入一个固定容积为5L的密闭容器中,在一定温度并有催化剂存在下,进行反应,经半分钟达到平衡,测得溶液中含YZ30.18mol,则v(O2)=________mol/(L·min);若温度不变,继续通入0.20molYZ2和0.10molO2,则平衡_______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(YZ3)<_______mol。
【题目】已知:NH4++OH-![]() NH3↑+H2O,有一瓶澄清的溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、Cl-中的几种,取该溶液进行如下实验:
NH3↑+H2O,有一瓶澄清的溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、Cl-中的几种,取该溶液进行如下实验:
(1)填表(在表中的空白处填写离子符号)
步骤 | 实验步骤 | 肯定不存在的离子 |
① | 用pH试纸测得该溶液呈酸性 | ________________ |
② | 另取l0mL该溶液逐滴加入稀NaOH溶液,使溶液从酸性逐渐变为碱性,此过程中无沉淀生成 | ________________ |
③ | 向②所得的溶液中加入足量Na2CO3溶液,过滤、洗涤、干燥,得到1.97g白色固体 | ________________ |
④ | 另取l0mL该溶液,加入浓NaOH溶液并加热,收集到224mL气体A(标准状况下) | |
⑤ | 另取l0mL该溶液,加入足量稀硝酸和AgNO3溶液,产生2.87g白色沉淀 |
(2)根据以上事实,在上述离子中,该溶液肯定存在的离子有________________。
(3)气体A溶于水可配成溶液A (该溶液的密度比水小),把50g浓度为c1的浓A溶液(溶质质量分数为ω1)与V mL水混合,得到浓度为c2的稀A溶液(溶质质量分数为ω2)。若ω1=2ω2,则:
①c1_____c2,②V_________50mL(填“>”“<”或“=”)。
【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:
2SO2(g)+O2(g) ![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是________。
SO2 压强 转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”), B点的化学平衡常数是______。

(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中含SO30.18mol。
① tl 时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是________。
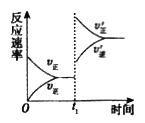
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
② 若继续通入0.20mol SO2和0.10molO2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”) ,再次达到平衡后,______mol3)<______mol。

