题目内容
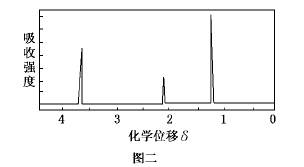
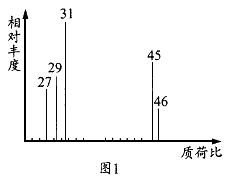
为了测定某有机物A的结构,做如下实验:①将2.3g该有机物完全燃烧,生成0.1mol CO2和?2.7g水;②用质谱仪测定其相对分子质量,得如图一所示的质谱图;③用核磁共振仪处理该化合物,得到如图二所示图谱,图中三个峰的面积之比是?1:2:3?.
试回答下列问题:
(1)有机物A的相对分子质量是 .
(2)有机物A的实验式是
(3)能否根据A的实验式确定A的分子式 (填”能”或”不能”),若能,则A的分子式是 (若不能,则此空不填).
(4)写出有机物A可能的结构简式 .

试回答下列问题:
(1)有机物A的相对分子质量是
(2)有机物A的实验式是
(3)能否根据A的实验式确定A的分子式
(4)写出有机物A可能的结构简式
分析:(1)根据质荷比可知,有机物A的相对分子质量为46;
(2)根据n=
计算生成的水的物质的量,计算碳元素、氢元素的质量,根据质量守恒判断有机物A是否含有氧元素,若含有氧元素,计算氧元素质量、氧原子物质的量,根据原子守恒确定有机物A中C、H、O原子个数比值确定最简式;
(3)根据有机物的最简式中H原子说明是否饱和C原子的四价结构判断;
(4)由核磁共振氢谱可知,该有机物分子中有3中化学环境不同的H原子,三种H原子数目之比为1:2:3,结合有机物的分子式确定其可能的结构.
(2)根据n=
| m |
| M |
(3)根据有机物的最简式中H原子说明是否饱和C原子的四价结构判断;
(4)由核磁共振氢谱可知,该有机物分子中有3中化学环境不同的H原子,三种H原子数目之比为1:2:3,结合有机物的分子式确定其可能的结构.
解答:解:(1)根据质荷比可知,有机物A的相对分子质量为46,故答案为:46;
(2)2.3g有机物燃烧生成0.1mol CO2,?2.7g水,
则n(C)=n( CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,
n(H2O)=
=0.15mol,n(H)=0.3mol,m(H)=0.3mol×1g/mol=0.3g,
则m(C)+m(H)=1.2g+0.3g=1.5g<2.3g,故有机物含有O元素,且m(O)=2.3g-1.5g=0.8g,故n(O)=
=0.05mol,
n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,即该有机物最简式为C2H6O,
故答案为:C2H6O;
(3)该有机物的最简式为C2H6O,H原子已经饱和C原子的四价结构,最简式即为分子式,
故答案为:能;C2H6O;
(4)由核磁共振氢谱可知,该有机物分子中有3中化学环境不同的H原子,三种H原子数目之比为1:2:3,有机物A的分子式为C2H6O,故该有机物结构式为CH3CH2OH,
故答案为:CH3CH2OH.
(2)2.3g有机物燃烧生成0.1mol CO2,?2.7g水,
则n(C)=n( CO2)=0.1mol,m(C)=0.1mol×12g/mol=1.2g,
n(H2O)=
| 2.7g |
| 18g/mol |
则m(C)+m(H)=1.2g+0.3g=1.5g<2.3g,故有机物含有O元素,且m(O)=2.3g-1.5g=0.8g,故n(O)=
| 0.8g |
| 16g/mol |
n(C):n(H):n(O)=0.1mol:0.3mol:0.05mol=2:6:1,即该有机物最简式为C2H6O,
故答案为:C2H6O;
(3)该有机物的最简式为C2H6O,H原子已经饱和C原子的四价结构,最简式即为分子式,
故答案为:能;C2H6O;
(4)由核磁共振氢谱可知,该有机物分子中有3中化学环境不同的H原子,三种H原子数目之比为1:2:3,有机物A的分子式为C2H6O,故该有机物结构式为CH3CH2OH,
故答案为:CH3CH2OH.
点评:本题考查有机物分子式与结构确定等,难度中等,注意燃烧法利用原子守恒确定有机物的分子式,侧重对基础知识与学生综合能力考查,注意对有机谱图的简单认识.

练习册系列答案
相关题目