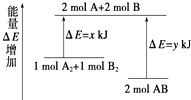
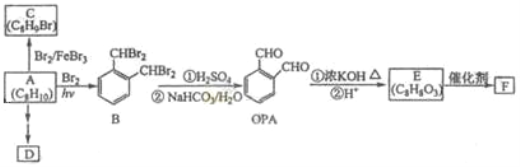
题目内容
【题目】金属及其化合物在生产中用途广泛。
I.利用生产硼砂的废渣一硼镁泥(主要成分为MgCO3、SiO2,还含有少量Fe2O3、MnO2、CaO等)为主要原料制取轻质碳酸镁[MgCO3·Mg(OH)2·2H2O]的工业流程如下:
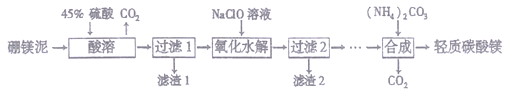
(1)写出“酸溶”一步中,MgCO3和硫酸反应的离子方程式________________________。
(2)滤渣2的主要成分有MnO2和________,写出生成MnO2的离子方程式_____________。
(3)“合成”时需通蒸汽至80℃,边加热边搅拌,温度不能超80℃的原因是______________。
II.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
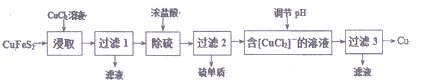
已知:①CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓ ②+1价的Cu在酸性条件下易歧化
(4)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为_________________。
(5)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为____________________。
(6)过滤3所得滤液中的CuCl2可循环使用,为保持流程持续循环,每生成1molCu,理论上需补充CuCl2的物质的量为_______。
【答案】 MgCO3+2H+=Mg2++H2O+CO2↑ Fe(OH)3 Mn2++ClO-+H2O=MnO2↓+2H++Cl- (NH4)2CO3受热分解[或(NH4)2CO3![]() 2 NH3↑+H2O+CO2↑] CuFeS2+3FeCl3=CuCl↓+ 4FeCl2+2S ↓ Fe2O3 0.5mol
2 NH3↑+H2O+CO2↑] CuFeS2+3FeCl3=CuCl↓+ 4FeCl2+2S ↓ Fe2O3 0.5mol
【解析】(1)写出“酸溶”一步中,硼镁泥中MgCO3和硫酸反应生成硫酸镁、二氧化碳和水,其反应的离子方程式为:MgCO3+2H+=Mg2++H2O+CO2↑;(2)滤渣2是氧化水解后过滤得到的滤渣,故主要成分有MnO2和水解产生的Fe(OH)3,MnO 溶于酸生成Mn2+,Mn2+被NaClO氧化生成MnO2,发生反应的离子方程式为:Mn2++ClO-+H2O=MnO2↓+2H++Cl-;(3)“合成”时需通蒸汽至80℃,边加热边搅拌,因为(NH4)2CO3受热易分解,发生反应(NH4)2CO3![]() 2 NH3↑+H2O+CO2↑,故温度不能超80℃;(4)浸取时,若改用FeCl3溶液,也能与CuFeS2反应生成CuCl和S,同时FeCl3被还原为FeCl2,该反应化学方程式为:CuFeS2+3FeCl3=CuCl↓+ 4FeCl2+2S ↓;(5)滤液中只含FeCl2,存在Fe2++2H2O
2 NH3↑+H2O+CO2↑,故温度不能超80℃;(4)浸取时,若改用FeCl3溶液,也能与CuFeS2反应生成CuCl和S,同时FeCl3被还原为FeCl2,该反应化学方程式为:CuFeS2+3FeCl3=CuCl↓+ 4FeCl2+2S ↓;(5)滤液中只含FeCl2,存在Fe2++2H2O![]() Fe(OH)2+2H+,加热促进水解,Fe(OH)2在空气中易氧化生成Fe(OH)3,生成的Fe(OH)3受热分解,最终所得固体的化学式为Fe2O3;(6)过滤3所得滤液中含有HCl和CuCl2,可以循环使用,涉及反应有CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓、2CuCl=Cu+ CuCl2,综合两个化学反应方程式可得CuFeS2+CuCl2=2Cu+FeCl2+2S↓,由方程式可得每生成1molCu,理论上需补充CuCl2的物质的量为0.5mol。
Fe(OH)2+2H+,加热促进水解,Fe(OH)2在空气中易氧化生成Fe(OH)3,生成的Fe(OH)3受热分解,最终所得固体的化学式为Fe2O3;(6)过滤3所得滤液中含有HCl和CuCl2,可以循环使用,涉及反应有CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓、2CuCl=Cu+ CuCl2,综合两个化学反应方程式可得CuFeS2+CuCl2=2Cu+FeCl2+2S↓,由方程式可得每生成1molCu,理论上需补充CuCl2的物质的量为0.5mol。