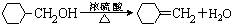题目内容
请按要求填空:
(1)除去NaCl固体中混有的少量KCl,所进行的实验操作依次为:______、蒸发、结晶、______.
(2)除去KCl溶液中的K2SO4,依次加入的溶液为(填溶质的化学式):______、______、______
写出反应的化学方程式______.______.______.
解:(1)氯化钠溶解度随温度变化不大,氯化钾随温度变化大,可以通过冷却热饱和溶液的方法进行除杂,先溶解,蒸发,冷却结晶,过滤得到晶体氯化钠;
故答案为:溶解、过滤;
(2)除去KCl溶液中的SO42-,应先加入过量BaCl2的使SO42-生成沉淀,然后加入K2CO3使过量的BaCl2生成沉淀,过滤后加入HCl除去过量的K2CO3,过程中反应的化学方程式为:BaCl2+K2SO4=BaSO4↓+2HCl;K2CO3+BaCl2=BaCO3↓+2KCl;2HCl+K2CO3=2KCl+H2O+CO2↑;
故答案为:BaCl2、K2CO3、HCl;BaCl2+K2SO4=BaSO4↓+2HCl;K2CO3+BaCl2=BaCO3↓+2KCl;2HCl+K2CO3=2KCl+H2O+CO2↑.
分析:(1)可以根据氯化钠溶解度随温度变化不大,氯化钾随温度变化大的性质进行除杂,结合过滤和蒸发结晶等方面的知识进行分析、判断,从而得出正确的结论.
(2)除去KCl溶液中的SO42-,应使SO42-离子转化为沉淀,注意不能引入新的杂质.
点评:本题考查了物质除杂的试剂选择,反应现象分析,化学方程式的书写,关键是不能引入新的杂质,题目较简单.
故答案为:溶解、过滤;
(2)除去KCl溶液中的SO42-,应先加入过量BaCl2的使SO42-生成沉淀,然后加入K2CO3使过量的BaCl2生成沉淀,过滤后加入HCl除去过量的K2CO3,过程中反应的化学方程式为:BaCl2+K2SO4=BaSO4↓+2HCl;K2CO3+BaCl2=BaCO3↓+2KCl;2HCl+K2CO3=2KCl+H2O+CO2↑;
故答案为:BaCl2、K2CO3、HCl;BaCl2+K2SO4=BaSO4↓+2HCl;K2CO3+BaCl2=BaCO3↓+2KCl;2HCl+K2CO3=2KCl+H2O+CO2↑.
分析:(1)可以根据氯化钠溶解度随温度变化不大,氯化钾随温度变化大的性质进行除杂,结合过滤和蒸发结晶等方面的知识进行分析、判断,从而得出正确的结论.
(2)除去KCl溶液中的SO42-,应使SO42-离子转化为沉淀,注意不能引入新的杂质.
点评:本题考查了物质除杂的试剂选择,反应现象分析,化学方程式的书写,关键是不能引入新的杂质,题目较简单.

练习册系列答案
相关题目

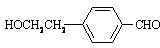 +2Ag(NH3)2OH
+2Ag(NH3)2OH +2Ag+3NH3+H2O
+2Ag+3NH3+H2O
 、
、