题目内容
[选修一物质结构与性质] (15分)
有X、Y、Z、Q、M 、E、N、G前四周期且原子序数递增的八种元素,其中X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素基态原子核外有两个电子层,最外层有3个未成对电子,Q的基态原子核外成对电子数是成单电子数的3倍,E原子得到一个电子后3p轨道全充满,G+中所有电子正好全部充满K、L、M三个电子层。M、N原子的价层电子构型为nS1,其电离能数据如下表:
回答下列问题:
(1)Z元素原子的价层电子的轨道表示式为: ;
(2)由X、Y形成的Y2X2分子中,含有 个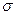 键, 个
键, 个 键:
键:
(3)比较ME、NE的熔点高低并说明理由 。
(4)Y、Z、Q的第一电离能由小到大的顺序为 。(用元素符号回答)
(5)YQ2中心原子的杂化方式为___________,有一种与YQ2互为等电子体的离子,能用于鉴别Fe3+ ,写出其电子式________________。
(6)GE的晶胞结构如图所示,阴离子周围最近的阳离子有 个;GE晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出计算式)。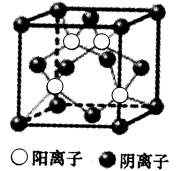
有X、Y、Z、Q、M 、E、N、G前四周期且原子序数递增的八种元素,其中X的原子中没有成对电子,Y元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子数相同,Z元素基态原子核外有两个电子层,最外层有3个未成对电子,Q的基态原子核外成对电子数是成单电子数的3倍,E原子得到一个电子后3p轨道全充满,G+中所有电子正好全部充满K、L、M三个电子层。M、N原子的价层电子构型为nS1,其电离能数据如下表:
| | M | N |
| 第一电离能(kJ/mol) | 495.8 | 418.8 |
(1)Z元素原子的价层电子的轨道表示式为: ;
(2)由X、Y形成的Y2X2分子中,含有 个
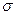 键, 个
键, 个 键:
键:(3)比较ME、NE的熔点高低并说明理由 。
(4)Y、Z、Q的第一电离能由小到大的顺序为 。(用元素符号回答)
(5)YQ2中心原子的杂化方式为___________,有一种与YQ2互为等电子体的离子,能用于鉴别Fe3+ ,写出其电子式________________。
(6)GE的晶胞结构如图所示,阴离子周围最近的阳离子有 个;GE晶体的密度为ag·cm-3,则晶胞的体积是 (只要求列出计算式)。

(1)
 (2分,没写2s 2p不扣分)
(2分,没写2s 2p不扣分)(2)3 2(2分,各1分)
(3)NaCl熔点高于KCl,Na+半小小于K+,Na+与Cl-形成的离子键强于K+与Cl-形成的离子键(或NaCl晶格能高于KCl)(3分)
(4)C < O < N(2分)
(5)SP (1分)
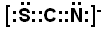 (2分)
(2分)(6)4(1分)
 (2分)
(2分)略

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目

 非金属元素,它们的原子序数依次增大。X、Y、Z的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。
非金属元素,它们的原子序数依次增大。X、Y、Z的单质在常温下均为无色气体,Y原子的最外层电子数是内层电子数的2倍。 元素编号
元素编号