题目内容
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是___________;仪器c的名称是________,反应结束后加适量冷水,再分离出苯乙酸粗品。加入冷水的目的是_________。下列仪器中可用于分离苯乙酸粗品的是_____________(填标号)。A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是_________,最终得到44 g纯品,则苯乙酸的产率是__________。
(4)用CuCl2·2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀。
(5)将苯乙酸加入到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体。
【答案】 滴加苯乙腈 球形冷凝管 便于苯乙酸析出 BCE 重结晶 95%
【解析】(2)由图可知,c为球形冷凝管,其作用为回流(或使气化的反应液冷凝),仪器b的作用为滴加苯乙腈;反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度,则加入冷水可便于苯乙酸析出;分离苯乙酸粗品,利用过滤操作,则需要的仪器为漏斗、烧杯、玻璃棒,故答案为BCE;
(3)苯乙酸微溶于冷水,在水中的溶解度较小,则提纯苯乙酸的方法是重结晶;由反应![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×
+NH4HSO4可知,40g苯乙腈生成苯乙酸为40g×![]() =46.5g,最终得到44g纯品,则苯乙酸的产率是
=46.5g,最终得到44g纯品,则苯乙酸的产率是![]() ×100%=95%。
×100%=95%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】根据下列实验现象所得出的结论错误的是
选项 | 实验 | 现象 | 结论 |
A | 向KBrO3溶液中加入少量苯,然后通入少量Cl2 | 有机层呈橙色 | 氧化性:Cl2> KBrO3 |
B | 向KNO3和KOH混合溶液中加入铝粉并加热, 将湿润的红色石蕊试纸放在试管口 | 试纸变为蓝色 | NO3-被还原为NH3 |
C | 向0.1 molL-1的Na2CO3溶液中加入两滴酚酞,溶液显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
D | 将0. 1 mol L-1的MgSO4溶液滴入到NaOH溶液中至不再有沉淀产生,再滴加0.1 molL-1的CuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | Ksp[Cu(OH)2]< Ksp[Mg(OH)2] |
A. A B. B C. C D. D
【题目】研究表明,化学反应的能量变化与反应物和生成物的键能有关。键能可以简单的理解为断开1mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
化学键 | P﹣P | P﹣O | O=O | P=O |
键能/kJ·mol﹣1 | 197 | X | 499 | 434 |
已知白磷的燃烧方程式为:P4(s)+5O2(g)=P4O10(s),该反应放出热量2378.0 kJ,且白磷分子结构为正四面体,4个磷原子分别位于正四面体的四个顶点,白磷完全燃烧的产物结构如下图所示,则下表中X为
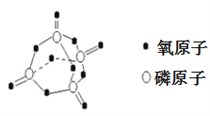
A. 410 B. 335 C. 360 D. 188