题目内容
甲、乙、丙、丁、戊五种元素的原子序数如表中所示,回答下列问题.
(1)甲与乙形成的最简单化合物的电子式为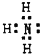
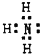 .
.
(2)用电子式表示丙与戊形成化合物的过程
 .
.
(3)甲与丁形成的化合物遇到戊的单质产生淡黄色粉末,试写出该反应的化学方程式:
(4)若某元素能形成的H2X和XO2两种化合物,X元素是上表中的
| 元素 | 甲 | 乙 | 丙 | 丁 | 戊 |
| 原子序数 | 1 | 7 | 11 | 16 | 17 |
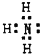
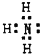
(2)用电子式表示丙与戊形成化合物的过程


(3)甲与丁形成的化合物遇到戊的单质产生淡黄色粉末,试写出该反应的化学方程式:
H2S+Cl2=2HCl+S↓
H2S+Cl2=2HCl+S↓
,其中戊单质做氧化
氧化
剂.(4)若某元素能形成的H2X和XO2两种化合物,X元素是上表中的
硫
硫
(填写元素名称),其位于周期表中的第二
第二
周期ⅥA
ⅥA
族.分析:甲的原子序数为1,则为H元素;乙的原子序数为7,则为N元素;丙的原子序数为11,则为Na元素;丁的原子序数为16,则为S元素;戊的原子序数为17,则为Cl元素.
(1)甲与乙形成的最简单化合物为NH3,氮原子与氢原子之间形成1对共用电子对;
(2)丙与戊形成化合物为NaCl,属于离子化合物,由钠离子与硫离子构成;
(3)甲与丁形成的化合物为H2S,遇到氯气产生淡黄色粉末,说明生成S,则还生成HCl,反应中氯元素的化合价降低,氯气做氧化剂;
(4)若某元素能形成的H2X和XO2两种化合物,X元素是上表中的 S元素,位于周期表中的第二周期ⅥA族.
(1)甲与乙形成的最简单化合物为NH3,氮原子与氢原子之间形成1对共用电子对;
(2)丙与戊形成化合物为NaCl,属于离子化合物,由钠离子与硫离子构成;
(3)甲与丁形成的化合物为H2S,遇到氯气产生淡黄色粉末,说明生成S,则还生成HCl,反应中氯元素的化合价降低,氯气做氧化剂;
(4)若某元素能形成的H2X和XO2两种化合物,X元素是上表中的 S元素,位于周期表中的第二周期ⅥA族.
解答:解:甲的原子序数为1,则为H元素;乙的原子序数为7,则为N元素;丙的原子序数为11,则为Na元素;丁的原子序数为16,则为S元素;戊的原子序数为17,则为Cl元素
(1)甲与乙形成的最简单化合物为NH3,电子式为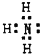 ,故答案为:
,故答案为: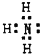 ;
;
(2)丙与戊形成化合物为NaCl,属于离子化合物,用电子式表示形成的过程为 ,
,
故答案为: ;
;
(3)甲与丁形成的化合物为H2S,遇到氯气产生淡黄色粉末,说明生成S,则还生成HCl,该反应的化学方程式为:H2S+Cl2=2HCl+S↓,其中氯元素化合价降低,氯气做氧化剂,
故答案为:H2S+Cl2=2HCl+S↓;氧化剂;
(4)若某元素能形成的H2X和XO2两种化合物,X元素是上表中的 S元素,位于周期表中的第二周期ⅥA族,
故答案为:硫;第二;ⅥA.
(1)甲与乙形成的最简单化合物为NH3,电子式为
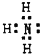 ,故答案为:
,故答案为: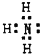 ;
;(2)丙与戊形成化合物为NaCl,属于离子化合物,用电子式表示形成的过程为
 ,
,故答案为:
 ;
;(3)甲与丁形成的化合物为H2S,遇到氯气产生淡黄色粉末,说明生成S,则还生成HCl,该反应的化学方程式为:H2S+Cl2=2HCl+S↓,其中氯元素化合价降低,氯气做氧化剂,
故答案为:H2S+Cl2=2HCl+S↓;氧化剂;
(4)若某元素能形成的H2X和XO2两种化合物,X元素是上表中的 S元素,位于周期表中的第二周期ⅥA族,
故答案为:硫;第二;ⅥA.
点评:本题考查结构物质性质关系、常用化学用语等,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
甲、乙、丙、丁、戊五种短周期元素在元素周期表中的位置如图,其中戊是金属元素.下列判断正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A、戊是两性元素 |
| B、五种元素中的金属元素中,丙的金属性最强 |
| C、简单离子半径:丙<丁 |
| D、甲的单质的熔点比丙单质的低 |


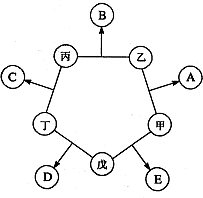 甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图所示:又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是日常生活中一种常见的金属.
甲、乙、丙、丁、戊五种单质在一定条件下反应生成A、B、C、D、E五种化合物,其转化关系如图所示:又知:①甲、乙、丙、丁均为前三周期元素的单质,常温下均为气态,丙、丁是空气的主要成分,戊是日常生活中一种常见的金属.