题目内容
有下列三个反应:
①Cl2+FeI2=FeCl2+I2
②2Fe2++Br2=2Fe3++2Br-
③Co2O3+6HCl=2CoCl2+Cl2↑+3H2O
下列说法正确的是( )
A.反应①②③中的氧化产物分别是I2、Fe3+、CoCl2
B.根据以上方程式可以得到氧化性:Cl2>Fe3+>Co2O3
C.在反应③中当1 mol Co2O3参加反应时,2 mol HCl被氧化
D.可以推理得到Cl2+FeBr2 =FeCl2+Br2
C
【解析】先分析化合价变化,确定各物质的氧化还原情况,根据氧化性:氧化剂>氧化产物,比较各物质氧化性强弱,然后再逐项判断。
分析三个反应中物质所含元素化合价的变化可得如下结论:
反应 | 结论 |
① | 氧化剂:Cl2,氧化产物:I2,氧化性:Cl2>I2 |
② | 氧化剂:Br2,氧化产物:Fe3+,氧化性:Br2>Fe3+ |
③ | 氧化剂:Co2O3,氧化产物:Cl2,氧化性:Co2O3>Cl2 |
结合上述反应以及元素周期律知识,可得氧化性:Co2O3>Cl2>Br2>Fe3+>I2,所以A项、B项均错误;反应③中电子转移的方向和数目可以表示为:
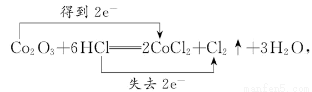
所以当有1 mol Co2O3参加反应时,有2 mol HCl被氧化,C项正确;根据氧化性:Co2O3>Cl2>Br2>Fe3+>I2,可知Cl2和FeBr2反应时,若有Br2生成,Fe2+应该被氧化完全,即不可能发生反应Cl2+FeBr2 =FeCl2+Br2。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目