题目内容
【题目】Ⅰ.已知:CO2(g)+ 3H2(g) ![]() CH3OH(g)+ H2O(g) △H
CH3OH(g)+ H2O(g) △H
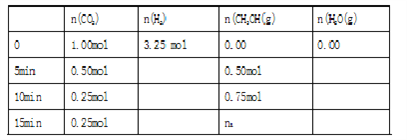
现在体积为1L的密闭容器中,充入CO2和H2。实验测得反应体系中物质的物质的量与时间关系如下表,
回答下列问题:
(1)表格中的n1=______________
(2)0-5min内 v (H2)=_______________
(3)该条件下CO2的平衡转化率为__________________
Ⅱ.在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g)。一定条件下发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H
CO(g)+3H2(g) △H
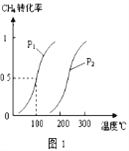
已知CH4的转化率与温度、压强的关系如图1所示。回答下列问题:
(4)100℃时平衡常数为_________________.
(5)图1中的p1_______p2(填“<”、“>”或“=”),其理由是:_________________
(6)若100℃时该可逆反应的平衡常数是K1,200℃该该可逆反应的平衡常数是K2,则K1___ K2(填“<”、“>”或“=”).其理由是__________________
【答案】 0.75mol 0.3 mol·L-1·min-1 75% 2.25×10-4 mol2·L-2 < 相同温度 时p1下CH4的转化率大于p2下CH4的转化率,根据方程式,压强越小转化率越高 < 据图像可知,该可逆反应的△H>0,温度升高,平衡正向移动。
【解析】Ⅰ. (1). 因为10分钟后,二氧化碳的物质的量保持不变了,说明反应达到了化学平衡状态,所以表格中的n1= 0.75mol 。
(2). 由表中数据可知,0-5min内氢气的变化量为二氧化碳的3倍,即1.5mol,所以 v (H2)= ![]() =
= ![]() =
=![]() = 0.3 mol·L-1·min-1
= 0.3 mol·L-1·min-1
(3). 该条件下CO2的平衡量为0.25mol,变化量为0.75mol,所以平衡转化率![]() =75%
=75%
Ⅱ. (4). 在容积为100L的密闭容器中,加入1.0molCH4和2.0molH2O(g)。一定条件下发生反应: CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H
CO(g)+3H2(g) △H
起始量(mol/L) 0.01 0.02 0 0
变化量(mol/L) 0.005 0.005 0.005 0.015
平衡量(mol/L) 0.005 0.015 0.005 0.015
所以100℃时平衡常数K=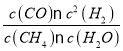 =
=![]() = 2.25×10-4 mol2·L-2
= 2.25×10-4 mol2·L-2
已知CH4的转化率与温度、压强的关系如图1所示。回答下列问题:
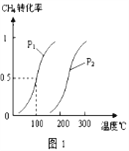
(5). 图1中的p1<p2(填“<”、“>”或“=”),其理由是:相同温度时p1下CH4的转化率大于p2下CH4的转化率,根据方程式,正反应是气体体积增大的方向,所以压强越小反应物的转化率越高。
(6)若100℃时该可逆反应的平衡常数是K1,200℃该该可逆反应的平衡常数是K2,则K1< K2(填“<”、“>”或“=”).其理由是据图像可知,该可逆反应的△H>0,是吸热反应,所以温度升高,平衡正向移动,化学平衡常数变大。

