题目内容
【题目】用50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热. 
起始温度t1/℃ | 终止温度t2/℃ | 温度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指温度;
(4)计算该实验发生中和反应时放出的热量为kJ[中和后生成的溶液的比热容c=4.18J(g℃)﹣1 , 稀溶液的密度都为1gcm﹣3];
(5)如果用50mL 0.55mol/L的氨水(NH3H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 .
【答案】
(1)量简和胶头滴管
(2)减少实验过程中的热量损失
(3)完全反应后混合溶液的最高
(4)1.34
(5)NH3?H2O是弱电解质,电离需要吸热(或生成的盐会水解,要吸收热量等)
【解析】解:(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是量筒和胶头滴管,所以答案是:量简和胶头滴管;(2)中和热测定实验中,必须尽量减少实验过程中热量的损失,所以答案是:减少实验过程中的热量损失;(3)氢氧化钠溶液与盐酸完全反应后混合溶液的最高温度为终止温度,所以答案是:完全反应后混合溶液的最高;(4)第三次得到温度差误差较大,应该舍弃,所以平均温度差为: ![]() =3.2℃,溶液的质量为:100ml×1g/ml=100g,则该反应中放出的热量为:Q=mc△T=100g×4.18J/(g℃)×3.2℃=1340J,即1.34kJ,所以答案是:1.34 kJ;(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,所以答案是:NH3H2O是弱电解质,电离需要吸热(或生成的盐会水解,要吸收热量等).
=3.2℃,溶液的质量为:100ml×1g/ml=100g,则该反应中放出的热量为:Q=mc△T=100g×4.18J/(g℃)×3.2℃=1340J,即1.34kJ,所以答案是:1.34 kJ;(5)氨水为弱碱,电离过程为吸热过程,所以用氨水代替稀氢氧化钠溶液反应,反应放出的热量小于57.3kJ,所以答案是:NH3H2O是弱电解质,电离需要吸热(或生成的盐会水解,要吸收热量等).

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】用50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液,在如图所示的装置中进行中和反应,测定强酸与强碱反应的反应热. 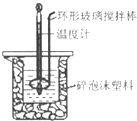
起始温度t1/℃ | 终止温度t2/℃ | 温度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪是;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指温度;
(4)计算该实验发生中和反应时放出的热量为kJ[中和后生成的溶液的比热容c=4.18J(g℃)﹣1 , 稀溶液的密度都为1gcm﹣3];
(5)如果用50mL 0.55mol/L的氨水(NH3H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 .