题目内容
向38.4g铜片中加入某浓度的硝酸150mL,在加热条件下反应,待铜片全部溶解后,收集到气体22.4L(标准状况下),求:(1)NO、NO2的体积各为多少?
(2)待反应产生的气体完全释放后,向溶液中加入V ml a mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度是多少?
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水多少克?
【答案】分析:(1)令混合气体中NO和NO2物质的量分别为xmol、ymol,利用电子转移守恒、二者物质的量之和列方程,据此计算x、y的值,再根据v=nVm计算NO、NO2的体积;
(2)向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH),根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO),再根据c= 计算;
计算;
(3)一氧化氮和二氧化氮变成硝酸钠需要失去电子总数等于铜与硝酸反应时失去电子数,也等于过氧化氢得到的电子数,以此计算需要双氧水的质量.
解答:解:n(Cu)=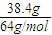 =0.6mol,n(气体)=
=0.6mol,n(气体)= =1mol,
=1mol,
(1)令混合气体中NO和NO2物质的量分别为xmol、ymol,则
 ,解得x=0.2,y=0.8,
,解得x=0.2,y=0.8,
则NO的体积为0.2mol×22.4mol/L=4.48L,NO2的体积为0.8mol×22.4L/mol=17.92L,
答:NO、NO2的体积各为4.48L、17.92L;
(2)向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH)=V×0.001L×amol/L=Va×10-3mol,根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO)=Va×10-3mol+1mol,故原有硝酸的物质的量浓度为 =
= mol/L,
mol/L,
答:原硝酸溶液的浓度是 mol/L;
mol/L;
(3)设需过氧化氢xmol,由电子守恒可知0.6mol×2=xmol×2×(2-1),解得x=0.6mol,其质量为0.6mol×34g/mol=20.4g,则需要30%的双氧水为 =68g,
=68g,
答:需要30%的双氧水68g.
点评:本题考查化学反应方程式的计算,明确铜与硝酸反应中的原子守恒及电子守恒是解答本题的关键,注意体会守恒法在计算中的重要应用,题目难度中等.
(2)向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH),根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO),再根据c=
 计算;
计算;(3)一氧化氮和二氧化氮变成硝酸钠需要失去电子总数等于铜与硝酸反应时失去电子数,也等于过氧化氢得到的电子数,以此计算需要双氧水的质量.
解答:解:n(Cu)=
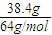 =0.6mol,n(气体)=
=0.6mol,n(气体)= =1mol,
=1mol,(1)令混合气体中NO和NO2物质的量分别为xmol、ymol,则
 ,解得x=0.2,y=0.8,
,解得x=0.2,y=0.8,则NO的体积为0.2mol×22.4mol/L=4.48L,NO2的体积为0.8mol×22.4L/mol=17.92L,
答:NO、NO2的体积各为4.48L、17.92L;
(2)向反应后溶液中加入NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液中溶质为NaNO3,由钠离子守恒n(NaNO3)=n(NaOH)=V×0.001L×amol/L=Va×10-3mol,根据氮原子守恒可知n(HNO3)=n(NaNO3)+n(NO2+NO)=Va×10-3mol+1mol,故原有硝酸的物质的量浓度为
 =
= mol/L,
mol/L,答:原硝酸溶液的浓度是
 mol/L;
mol/L;(3)设需过氧化氢xmol,由电子守恒可知0.6mol×2=xmol×2×(2-1),解得x=0.6mol,其质量为0.6mol×34g/mol=20.4g,则需要30%的双氧水为
 =68g,
=68g,答:需要30%的双氧水68g.
点评:本题考查化学反应方程式的计算,明确铜与硝酸反应中的原子守恒及电子守恒是解答本题的关键,注意体会守恒法在计算中的重要应用,题目难度中等.

练习册系列答案
相关题目
 某中学高一课外兴趣小组为探究铜跟硫酸的反应情况,设计了如图所示装置进行有关实验.
某中学高一课外兴趣小组为探究铜跟硫酸的反应情况,设计了如图所示装置进行有关实验. 试剂:a.NaOH溶液 b.品红溶液 c.酸性KMnO4溶液 d.Ca(OH)2溶液
试剂:a.NaOH溶液 b.品红溶液 c.酸性KMnO4溶液 d.Ca(OH)2溶液