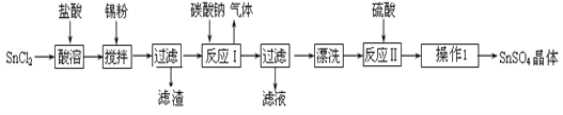
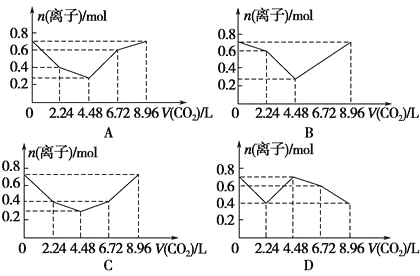
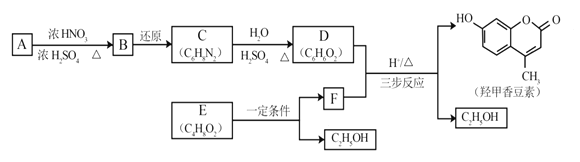
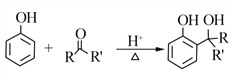
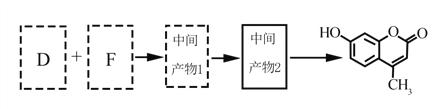
题目内容
【题目】已知:2Zn(s)+O2(g)![]() 2ZnO(s) ΔH=701.0 kJ·mol1
2ZnO(s) ΔH=701.0 kJ·mol1
2Hg(l)+O2(g)![]() 2HgO(s) ΔH=181.6 kJ·mol1
2HgO(s) ΔH=181.6 kJ·mol1
则反应Zn(s)+HgO(s)![]() ZnO(s)+Hg(l)的ΔH为
ZnO(s)+Hg(l)的ΔH为
A.+519.4 kJ·mol1 B.+259.7 kJ·mol1 C.259.7 kJ·mol1 D.519.4 kJ·mol1
【答案】C
【解析】把已知两个热化学方程式依次编号为①、②,由盖斯定律可知,(①②)÷2可得反应Zn(s)+HgO(s)![]() ZnO(s)+Hg(l),将相应的反应热代入计算可得答案。即ΔH=[701.0 kJ·mol1(181.6 kJ·mol1)]÷2=259.7 kJ·mol1。
ZnO(s)+Hg(l),将相应的反应热代入计算可得答案。即ΔH=[701.0 kJ·mol1(181.6 kJ·mol1)]÷2=259.7 kJ·mol1。

练习册系列答案
相关题目