题目内容
8.t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)?2SO3(g),△H=-196.6kJ/mol.2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:(1)从反应开始到达化学平衡,生成SO3的平均反应速率为0.1mol/(L•min);平衡时SO2转化率为20%.
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)ABE.
A.容器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是AD.
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%,SO2的转化率为80%.
分析 (1)参加反应氧气为1mol-0.8mol=0.2mol,由方程式可知△n(SO2)=△n(SO3)=2△n(O2)=0.4mol,根据v=$\frac{△c}{△t}$计算v(SO3),转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
(2)可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(3)A.向容器中通入少量O2,平衡正向移动;
B.向容器中通入少量SO2,二氧化硫转化率降低;
C.使用催化剂不影响平衡移动;
D.降低温度,平衡向放热反应方向移动;
E.向容器中通入少量氦气,各物质的浓度不变,平衡不移动;
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,设二者起始物质的量均为1mol,反应达到平衡时,混合气体体积减少了20%,则气体物质的量减小2mol×20%=0.4mol,利用差量法计算参加反应二氧化硫的物质的量,进而计算SO2的转化率.
解答 解:(1)参加反应氧气为1mol-0.8mol=0.2mol,由方程式可知△n(SO2)=△n(SO3)=2△n(O2)=0.4mol,则v(SO3)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.1mol/(L•min),平衡时二氧化硫转化率=$\frac{0.4mol}{2mol}$×100%=20%,
故答案为:0.1mol/(L•min);20%;
(2)A.随反应进行气体物质的量减小,恒温恒容下,容器内压强减小,当容器内压强不再发生变化,说明到达平衡,故A正确;
B.SO2的体积分数不再发生变化,说明反应到达平衡,故B正确;
C.容器内气体原子总数始终不发生变化,故C错误;
D.相同时间内消耗2nmolSO2的同时消耗nmolO2,均表示正反应速率,反应始终按该比例关系进行,故D错误;
E.相同时间内消耗2nmolSO2的同时生成nmolO2,而生成nmolO2的同时生成2nmolSO2,二氧化硫的生成速率与消耗速率相等,反应到达平衡,故E正确,
故选:ABE;
(3)A.向容器中通入少量O2,平衡正向移动,SO2转化率增大,故A正确;
B.向容器中通入少量SO2,平衡虽然正向移动,但SO2转化率降低,故B错误;
C.使用催化剂可以加快反应速率,但不影响平衡移动,SO2转化率不变,故C错误;
D.正反应为放热反应,降低温度,平衡向正向移动,SO2转化率增大,故D正确;
E.向容器中通入少量氦气,各物质的浓度不变,平衡不移动,SO2转化率不变,故E错误,
故选:AD;
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,设二者起始物质的量均为1mol,反应达到平衡时,混合气体体积减少了20%,则气体物质的量减小2mol×20%=0.4mol,
2SO2(g)+O2(g)?2SO3(g) 物质的量减小
2 2 1
0.8mol 0.8mol 0.4mol
故SO2的转化率=$\frac{0.8mol}{1mol}$×100%=80%,
故答案为:80%.
点评 本题考查化学平衡计算与影响因素、化学平衡状态判断,注意判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡.

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4 (g)+4NO2 (g)=4NO(g)+CO2 (g)+2H2 O(g)△H=-574kJ•mol-1
②CH4 (g)+4NO(g)=2N2 (g)+CO2 (g)+2H2 O(g)△H=-1160kJ•mol-1
③H2O(g)=H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)△H=-955kJ•mol-1
(2)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g)某研究小组向恒容密闭容器加入一定的活性炭和NO,恒温条件下反应,反应进行到不同时间测得各物质的浓度如下
 | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
A.容器内CO2的浓度保持不变 B.v正(N2)=2v正(NO)
C.容器内压强保持不变 D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在该温度下时.该反应的平衡常数为0.56(保留两位小数);
③在30min,改变某一条件,反应重新达到平衡,则改变的条件是减小二氧化碳浓度.
(3)合成塔失去活性的铬锌触媒可用于制备锌锰电池.在碱性条件下,该电池的总反应为:
Zn(s)+2MnO2 (s)+H2O(l)=Zn(OH)2 (s)+Mn2O3(s),该电池正极的电极反应式是2MnO2+2e-+H2O=2OH-+Mn2O3.PbO2 可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取.阳极发生反应的电极反应式为Pb2++2H2O-2e-=PbO2+4H+,阴极上观察到的现象是;石墨上红色物质析出若电解液中不加入Cu(NO3)2这样做的主要缺点是Pb将在阴极析出,Pb2+不能得到有效应用.
| A. | HCl 和 NaOH 反应的中和热△H=-57.3 kJ/mol,则浓 H2SO4和 Ca(OH)2反应的中和热 △H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是 283.0 kJ/mol,则 2CO2(g)═2CO(g)+O2(g)反应的△H=2×283.0 kJ/mol | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏大 |
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 46.0 | a | b |
| 915 | c | 25.0 | d |
| 1000 | e | f | 15.0 |
(1)欲提高C的产率,应采取的措施为升高温度、降低压强;
(2)该反应△H> 0(填“<”或“>”);
(3)比较K(810℃)< K(915℃) (填“<”、“>”或“=”),说明理由升高温度平衡向正向移动,因此平衡常数增大;
(4)915℃2.0MP时A的转化率为60%;
(5)比较b>f(填“<”、“>”或“=”),说明理由升温平衡正向移动所以f<25.0<a,增大压强平衡逆向移动所以a<b,所以b>f;
(6)若1000℃,3.0MPa时,向容器中加入0.16mol A和0.20mol B,平衡时容器体积为10L,则此时平衡常数K=0.133(保留两位有效数字).
| 族 周期 | IA | 0 | |||||||
| 1 | ① | II A | III A | IV A | V A | VI A | VIIA | ||
| 2 | ② | ③ | Ne | ||||||
| 3 | ④ | ⑤ | Al | S | ⑥ | ||||
(2)②的原子结构示意图是
 ;
;(3)由①和③两种元素组成的化合物的化学式是NH3;
(4)④和⑤两种元素的金属性强弱顺序是④> ⑤(填“<”或“>”).
(5)④的最高价氧化物对应的水化物与A1(0H)3反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O.
| A. | 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧后所得固体成分相同 | |
| B. | 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度 | |
| C. | 用加热的方法可以除去KNO3溶液中混有的Fe3+ | |
| D. | 相同物质的量浓度的碳酸钠溶液和碳酸氢钠溶液后者pH大 |
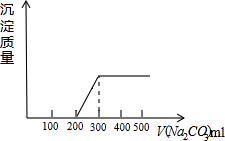 100mL盐酸与CaCl2混合液中,逐滴加入Na2CO3溶液,生成的沉淀与加入的Na2CO3生成沉淀的质量与加入的Na2CO3生溶液的体积之间的关系如图,已知氯化钙的物质的量浓度为0.025mol/L,
100mL盐酸与CaCl2混合液中,逐滴加入Na2CO3溶液,生成的沉淀与加入的Na2CO3生成沉淀的质量与加入的Na2CO3生溶液的体积之间的关系如图,已知氯化钙的物质的量浓度为0.025mol/L,