题目内容
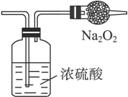
某无色气体可能由CO2、HCl、NH3、NO、NO2、H2中的一种或几种组成.将此气体依次通过浓H2SO4(气体体积减少一部分),通过Na2O2(气体变红),最后通入盛满水且倒立于水槽内的试管,最后试管中仍为一满管液体.据此判断可知( )A.原气体含有NH3、NO、NO2、HCl
B.原气体仅含CO2和NO,且CO2与NO的体积比为3∶2
C.原气体含有NH3、NO和CO2,且CO2与NO的体积比为3∶2
D.原混合气体中不含HCl和NO2,也不含H2
答案:C
解析:
解析:
| 因混合气为无色气体,故不含NO2;通过浓H2SO4被吸收一部分气体,该气体为NH3,故一定不含HCl;通过Na2O2时气体变红,说明原混合气含CO2、NO;通入水槽,要使气体完全被吸收,则 V(NO)∶V(O2)=4∶3(4NO+3O2+2H2O====4HNO3)故V(CO2)∶V(NO)=3∶2.(2CO2+2Na2O2====2Na2CO3+O2)
|

练习册系列答案
相关题目