题目内容
工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯
 (g)+CO2(g)
(g)+CO2(g)
 (g)+CO(g)+H2O(g) ΔH=-166 kJ·mol-1
(g)+CO(g)+H2O(g) ΔH=-166 kJ·mol-1
(1)①乙苯与CO2反应的平衡常数表达式为:K= 。
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。

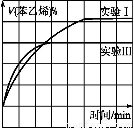
(2)在3 L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0 mol·L-1和3.0 mol·L-1,其中实验Ⅰ在T1℃,0.3 MPa,而实验Ⅱ、Ⅲ分别改变了实验其他条件;乙苯的浓度随时间的变化如图1所示。
 ??????????????????????
?????????????????????? 
????????? 图1???????????????????????????????????? 图2
①实验Ⅰ乙苯在0~50 min时的反应速率为 。
②实验Ⅱ可能改变的条件是 。
③图2是实验Ⅰ中苯乙烯体积分数V%随时间t的变化曲线,请在图2中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线。
(3)若实验Ⅰ中将乙苯的起始浓度改为1.2 mol·L-1,其他条件不变,乙苯的转化率将 (填“增大”“减小”或“不变”),计算此时平衡常数为 。
(1)K=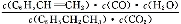 BD
BD
(2)①0.012 mol·L-1·min-1 ②加入催化剂
③
(3)减小 0.225
【解析】(1)B选项,因为是绝热容器,化学平衡发生移动,体系温度改变,平衡常数也改变,所以平衡常数不再随时间的改变而改变,一定是化学平衡状态;(2)②实验Ⅱ比Ⅰ化学反应速率快,但平衡状态相同,只能是加入催化剂;③实验Ⅲ化学反应速率加快,平衡时乙苯的浓度增大,苯乙烯的百分含量减小;(3)只改变浓度,所以平衡常数与实验Ⅰ相同,K=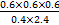 =0.225
=0.225

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案





