题目内容
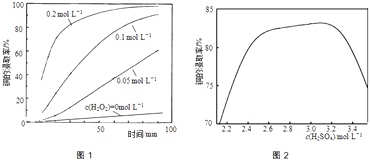
【题目】U、V、W、X、Y、Z是六种常见的短周期主族元素,其中W、X、Y、Z原子半径随原子序数的变化如图所示:
已知Y的最高价氧化物对应的水化物可与其简单氢化物反应可生成离子型晶体的一种盐;Z是地壳中含量最多的元素;W原子的最外层电子数与Ne原子的最外层电子数相差1;U原子最外层电子数是次外层电子数的两倍;V为原子核内有12个中子的二价金属,当2.4克V与足量热水反应时,在标准状况下放出气体2.24L;请回答下列问题:
(1)指出Y元素在周期表中的位置;
(2)写出W的简单离子的结构示意图;
(3)比较W的气态氢化物与H2S和HF的稳定性(由强到弱):
(4)由W、Y两种元素组成的一种化合物,每个原子最外层均达到8电子稳定结构,写出该化合物的电子式;
(5)UZ2的结构式为
(6)由X、Y、Z三种元素组成的化合物,是一种常见的化肥,其原子个数比为4:2:3,则该物质含有的化学键类型为;
(7)V与W两元素最高价氧化物的水化物反应的离子方程式 .
【答案】
(1)第二周期ⅤA族
(2)![]()
(3)HF>HCl>H2S
(4)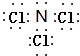
(5)O=C=O
(6)离子键、共价键
(7)Mg(OH)2+2H+=Mg2++2H2O
【解析】解:Y的最高价氧化物对应的水化物可与其简单氢化物反应可生成离子型晶体的一种盐,则Y为N元素;Z是地壳中含量最多的元素,则Z是O元素;W原子的最外层电子数与Ne原子的最外层电子数相差1,则W最外层电子数为7,原子半径大于O原子半径,故W为Cl元素;X的原子序数小于N,且原子半径小于N,故X为H元素;U原子最外层电子数是次外层电子数的两倍,原子只能有2个电子层,最外层电子数为4,故U为C元素;V为原子核内有12个中子的二价金属,令其相对分子质量为a,根据电子转移守恒,则: ![]() ×2=
×2= ![]() ×2,解得=24,则V的质子数为24﹣12=12,故V为Mg.(1)Y为N元素,在周期表中的位置:第二周期ⅤA族,所以答案是:第二周期ⅤA族;(2)W的简单离子为Cl﹣ , Cl﹣的结构示意图为
×2,解得=24,则V的质子数为24﹣12=12,故V为Mg.(1)Y为N元素,在周期表中的位置:第二周期ⅤA族,所以答案是:第二周期ⅤA族;(2)W的简单离子为Cl﹣ , Cl﹣的结构示意图为 ![]() ,所以答案是:
,所以答案是: ![]() ;(3)氢化物稳定性与元素非金属性一致,非金属性F>Cl>S,故氢化物稳定性:HF>HCl>H2S,所以答案是:HF>HCl>H2S;(4)由W、Y两种元素组成的一种化合物,每个原子最外层均达到8电子稳定结构,该化合物为NCl3 , 该化合物的电子式为
;(3)氢化物稳定性与元素非金属性一致,非金属性F>Cl>S,故氢化物稳定性:HF>HCl>H2S,所以答案是:HF>HCl>H2S;(4)由W、Y两种元素组成的一种化合物,每个原子最外层均达到8电子稳定结构,该化合物为NCl3 , 该化合物的电子式为 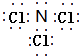 ,所以答案是:
,所以答案是: 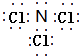 ;(5)UZ2为CO2 , 结构式为O=C=O,所以答案是:O=C=O;(6)由X、Y、Z三种元素组成的化合物,是一种常见的化肥,其原子个数比为4:2:3,该物质为NH4NO3 , 含有离子键、共价键,所以答案是:离子键、共价键;(7)V与W两元素最高价氧化物的水化物分别为Mg(OH)2、HClO4 , 二者反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O,所以答案是:Mg(OH)2+2H+=Mg2++2H2O.
;(5)UZ2为CO2 , 结构式为O=C=O,所以答案是:O=C=O;(6)由X、Y、Z三种元素组成的化合物,是一种常见的化肥,其原子个数比为4:2:3,该物质为NH4NO3 , 含有离子键、共价键,所以答案是:离子键、共价键;(7)V与W两元素最高价氧化物的水化物分别为Mg(OH)2、HClO4 , 二者反应的离子方程式:Mg(OH)2+2H+=Mg2++2H2O,所以答案是:Mg(OH)2+2H+=Mg2++2H2O.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案