题目内容
已知:3CH4(g) + 2N2(g) 3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如下图所示,下列说法正确的是( )
3C(s) + 4NH3(g) ΔH>0,在700℃,CH4与N2在不同物质的量之比[n(CH4)/n(N2)]时CH4的平衡转化率如下图所示,下列说法正确的是( )
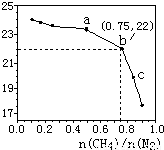
A.n(CH4)/n(N2)越大,CH4的转化率越高
B.n(CH4)/n(N2)不变时,若升温,NH3的体积分数会增大
C.b点对应的平衡常数比a点的大
D.b点对应的NH3的体积分数约为26%
某实验小组拟用酸碱中和滴定法测定食醋的总酸量(g/100mL),现邀请你参与本实验并回答相关问题。(有关实验药品为:市售食用白醋样品500mL、0.1000mol/LNaOH标准溶液、蒸馏水、0.1%甲基橙溶液、0.1%酚酞溶液、0.1%石蕊溶液)。
实验步骤:
A.用滴定管量取10mL市售白醋样品,置于100mL容量瓶中,加蒸馏水(煮沸除去CO2并迅速冷却)稀释至刻度线,摇匀即得待测食醋溶液。
B.用酸式滴定管取待测食醋溶液20.00mL于锥形瓶中,并滴加酚酞指示剂待用。
C.碱式滴定管盛装标准NaOH溶液,静置后,读取数据,记录为NaOH标准溶液体积的初读数。
D.滴定,并记录NaOH的终读数。重复滴定2-3次。
E.实验数据记录
1 | 2 | 3 | 4 | |
V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)/mL(初读数) | 0.00 | 0.200 | 0.10 | 0.00 |
V(NaOH)/mL(终读数) | 14.98 | 15.20 | 15.12 | 15.95 |
V(NaOH)/mL(消耗) | 14.98 | 15.00 | 15.02 | 15.95 |
(1)则c(样品)/moL•L-1=_________;样品总酸量=_________g/100mL。
(2)判断D步骤操作时溶液到达滴定终点的方法是________________。
(3)若上述B步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果产生的影响是_________(填“无影响”、“偏大”或“偏小”,下同);若在D步骤用碱式滴定管时开始没有气泡,后产生气泡,则对滴定结果产生的影响是___________;若D步骤滴定前平视读数,滴定终点时俯视读数 ,则对滴定结果产生的影响是__________。
,则对滴定结果产生的影响是__________。
煤是一种重要的化工原料,人们将利用煤制取的水煤气、焦炭、甲醚等广泛用于工农业生产中。(1)已知:
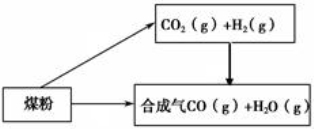
①C(s) + H2O(g) = CO(g)+H2(g) ΔH=+131.3 kJ·mol -1
-1
②CO2(g) + H2(g) = CO(g) + H2O(g) ΔH=+41.3 kJ·mol-1
则碳与水蒸气反应生 成二氧化碳和氢气的热化学方程式为
成二氧化碳和氢气的热化学方程式为
该反应在 (填“高温”、“低温”或“任何温度”)下有利于正向自发进行。
(2)有人利用炭还原法处理氮氧化物,发生反应C(s)+2NO(g) N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
N2(g)+CO2(g)。向某密闭容器中加入一定量的活性炭和NO,在T1℃时,不同时间测得各物质的浓度如下表所示:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 (3)研究表明:反应CO(g)+H2O(g)
若反应在500℃时进行,设起始时CO和H2O的浓度均为0.020 mol·L-1,在该条件下达到平衡时,CO的转化率为 (4)用CO做燃料电池电解CuSO4溶液、FeCl3和FeCl2混合液的示意图如图1所示,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后,断开K,此时A、B两极上产生的气体体积相同。
图1中A极产生的气体在标准状况下的体积为 ②电极为C、D的装置溶液中金属阳离子的物质的量与转移电子的物质的量变化关系如图2所示,则图中③线表示的是 (填离子符号)的变化;反应结束后,要使丙装置中金属阳离子恰好完全沉淀,需要 mL 5.0 mol·L-1NaOH溶液。 |


 H2(g)+CO2(g)平衡常数随温度的变化如下表所示:
H2(g)+CO2(g)平衡常数随温度的变化如下表所示: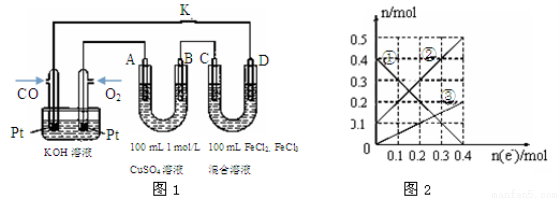

 通入足量的CO2CO32-+
通入足量的CO2CO32-+ CO2+H2O=2HCO3-
CO2+H2O=2HCO3-
 2NH3(正反应是放热反应)。下列有关说法正确的是
2NH3(正反应是放热反应)。下列有关说法正确的是