题目内容
【题目】在一定温度时,N2与H2反应过程中能量变化的曲线如右图所示。下列叙述正确的是( )
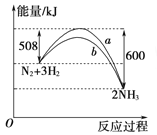
A. 该反应的热化学方程式:N2+3H2 = 2NH3ΔH=-92 kJ/mol
B. b曲线是加入催化剂时的能量变化曲线
C. 加入催化剂,该化学反应放出的热量增多
D. 加入催化剂可增大正反应速率,降低逆反应速率
【答案】B
【解析】试题分析:A.反应热与反应的物质多少及物质的存在状态有关,书写热化学方程式时,没有注明物质的聚集状态,错误;B.加入催化剂,可以改变反应途径,降低反应的活化能,正确;C. 加入催化剂,可以降低反应的活化能,但是不能改变反应物、生成物所具有的能量,因此该化学反应放出的热量不变,错误;D.加入催化剂可增大正反应速率,同时也增大逆反应速率,而且二者增大的速率相同,错误。

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
【题目】下述实验能达到预期目的的是( )
编号 | 实验内容 | 实验目的 |
A | 将SO2通入酸性KMnO4溶液中 | 证明SO2具有氧化性 |
B | 将Cl2通入NaBr溶液中 | 比较氯与溴的氧化性强弱 |
C | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
D | 分别向2支试管中加入相同体积不同浓度的H2O2溶液,再向其中1支加入少量MnO2 | 研究催化剂对H2O2分解速率的影响 |
A. A B. B C. C D. D

