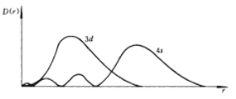
题目内容
【题目】I 工业上已经实现CO2与H2反应合成甲醇。在一恒温、恒容密闭容器中充入2molCO2和6molH2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
CH3OH(g)+H2O(g)。测得CO2和CH3OH(g)的浓度随时间变化如下图所示。 请回答:
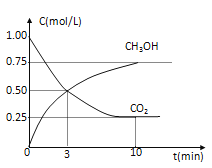
(1) 在前10min内,用CO2浓度的变化表示的反应速率![]() (CO2)=________mol·L-1·min-1。
(CO2)=________mol·L-1·min-1。
(2)10min时体系的压强与开始时压强之比为______。
(3)该温度下,反应的化学平衡常数数值是__________。
Ⅱ氢气是一种理想的绿色能源,利用生物质发酵得到的乙醇制取氢气,具有良好的应用前景。乙醇水蒸气重整制氢的部分反应过程如1图所示:
已知:反应I和反应II的平衡常数随温度变化曲线如图2所示。
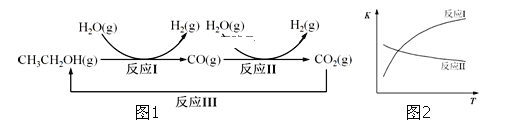
(4)反应I中,1molCH3CH2OH(g)参与反应后的热量变化是256kJ
①H2O的电子式是______
②反应I的热化学方程式是_________________________________
(5)反应II,在进气比[n(CO):n(H2O)不同时,测得相应的CO的平衡转化率见图3(各点对应的反应温度可能相同,也可能不同)
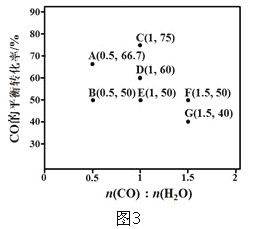
①图中D、E两点对应的反应温度分别为TD和TE。判断:TD______TE (填“>”“< ” 或“=”)
②经分析,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的______相同。
③当不同的进气比达到相同的CO平衡转化率时,对应的反应温度和进气比的关系是_________________。
【答案】0.075 5:8 5.3 ![]()
![]() < 化学平衡常数 进气比越大,反应温度越低
< 化学平衡常数 进气比越大,反应温度越低
【解析】
(1)V=△c/△t计算
(2)气体压强之比等于气体物质的量之比计算;
(3)根据化学平衡常数的定义求解;
(4)①水为共价化合物,据此进行分析;
②根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态,根据燃烧热的概念结合热化学方程式的书写来回答;
③由图可知,当CO的转化率相同时,温度由低到高对应的进气比为0.5、1、1.5,由此可确定温度与进气比的关系;
I. CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始量(mol·L-1) 1 3 0 0
起始量(mol·L-1) 0.75 2.25 0.75 0.75
平衡量(mol·L-1) 0.25 0.75 0.75 0.75
(1) 在前10min内,用CO2浓度的变化表示的反应速率![]() (CO2)=0.75mol·L-1÷10min=0.075mol·L-1·min-1。
(CO2)=0.75mol·L-1÷10min=0.075mol·L-1·min-1。
(2)容器内的平衡压强与起始压强之比=气体物质的量之比=(0.25+0.75+0.75+0.75)×2:8=5:8;
(3)该温度下,反应的化学平衡常数数值是=0.752÷(0.753×0.25)=5.3;。
Ⅱ(4)①水为共价化合物,故水的电子式为:![]() ,
,
②反应I的热化学方程式是CH3CH2OH(g)+H2O(g)═4H2(g)+2CO(g)△H=+256 kJ·mol-1;
(5)①已知CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=-42kJ·mol-1,反应为放热反应,升温平衡逆向进行,CO转化率减小,图中D、E两点对应的反应温度分别为TD和TE.D点CO转化率大于E点CO转化率,说明TD<TE ;
CO2(g)+H2(g)△H=-42kJ·mol-1,反应为放热反应,升温平衡逆向进行,CO转化率减小,图中D、E两点对应的反应温度分别为TD和TE.D点CO转化率大于E点CO转化率,说明TD<TE ;
②E点平衡常数
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量 1 1 0 0
变化量 0.5 0.5 0.5 0.5
平衡量 0.5 0.5 0.5 0.5
K=1
A点平衡常数
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量 1 2 0 0
变化 2/3 2/3 2/3 2/3
平衡 1/3 4/3 2/3 2/3
K=1
G点平衡常数
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
起始量 3 2 0 0
变化量 1.2 1.2 1.2 1.2
平衡量 18 0.8 1 2 1.2
K=(1.2×1.2) ÷(1.8×0.8)=1,
故与图2中E点对应的反应温度相同的为A、G,A、E和G三点对应的反应温度相同,其原因是A、E和G三点对应的化学平衡常数相同;
③由图可知,当CO的转化率相同时,温度由低到高对应的进气比为0.5、1、1.5,进气比越高达到相同转化率所需的温度越低。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】如图利用培养皿探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水,立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是

选项 | 实验现象 | 解释 |
A | 浓盐酸附近产生白烟 | NH3与浓盐酸反应生成了NH4Cl固体 |
B | 浓硫酸附近无明显现象 | NH3与浓硫酸不发生反应 |
C | 氯化物溶液变浑浊 | 该溶液一定是AlCl3溶液 |
D | 干燥的红色石蕊试纸不变色,湿润的红色石蕊试纸变蓝 | NH3是一种可溶性碱 |
A. AB. BC. CD. D
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
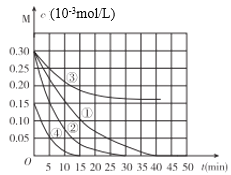
实验编号 | 温度°C | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验①④说明M的浓度越小,降解的速率越快