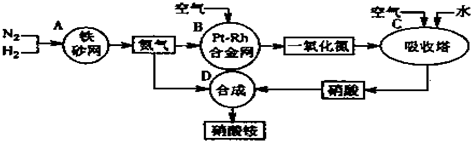
题目内容
12.下列反应中气体作氧化剂的是( )| A. | SO3通入水中:SO3+H2O═H2SO4 | |
| B. | Cl2通入FeCl2溶液中:Cl2+2FeCl2═2FeCl3 | |
| C. | HCl气体通入NaOH溶液中:HCl+NaOH═NaCl+H2O | |
| D. | CO2通入NaOH溶液中:CO2+2NaOH═Na2CO3+H2O |
分析 气体作氧化剂,则气体中某元素的化合价降低,以此来解答.
解答 解:A.没有元素的化合价变化,不发生氧化还原反应,故A错误;
B.氯气中Cl元素的化合价降低,则氯气作氧化剂,故B正确;
C.没有元素的化合价变化,不发生氧化还原反应,故C错误;
D.没有元素的化合价变化,不发生氧化还原反应,故D错误;
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.关于如图所示装置的叙述,错误的是( )


| A. | 锌是负极,其质量逐渐减小 | B. | 氢离子在铜表面被还原,产生气泡 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 电子从锌片经硫酸溶液流向铜片 |
20.化合物X是一种重要的有机合成中间体,用于制造塑料、涂料和粘合剂等高聚物.为研究X的组成与结构,某研究小组进行了如下实验:
(4)化合物X与乙烯的共聚物是一种热熔型粘合剂.合成这种粘合剂的化学方程式是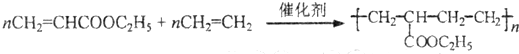 .
.
(5)研究小组以乙烯为原料,在实验室合成了化合物X.请写出合成路线流程图,并注明反应条件.
已知: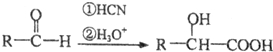
合成路线流程图示例如下:$→_{条件1}^{试剂1}$产物$→_{条件2}^{试剂2}$产物2…,下列合成步骤可以用完,也可以不用完,不够时也可以自己加.前面合成出来的物质可以作为原料在后面的合成中直接使用(如图).
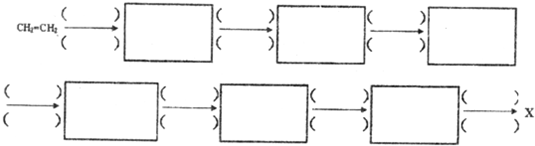
(6)工业上合成化合物X的一种方法可用如图表示:

已知: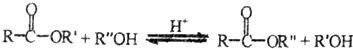
①1mol链状化合物A能与2mol H2发生反应,但A分子中不含有碳碳三键,则A的结构简式是CH2=C=O.
②B分子中含有四元环状结构,则反应I的反应类型是加成反应;反应Ⅱ的化学方程式是 .
.
③与(5)实验室制法比较,本方法的优点是步骤少,原子利用率高.
(1)化合物X的质谱图为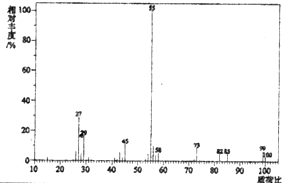 | (1)有机物X的相对分子质量是100. |
| (2)将10.0g X在足量O2中充分燃烧,并使其产物依次通过足量的无水CaCl2和KOH浓溶液,发现无水CaCl2增重7.2g,KOH浓溶液增重22.0g. | (2)有机物X的分子式是C5H8O2. |
| (3)经红外光谱测定,化合物X中含有酯基,并有和羰基直接相连的碳碳双键;化合物 X的核磁共振氢谱图上有4个吸收峰,峰面积之比是2:1:2:3. | (3)X的结构简式是 . . |
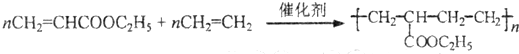 .
.(5)研究小组以乙烯为原料,在实验室合成了化合物X.请写出合成路线流程图,并注明反应条件.
已知:
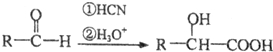
合成路线流程图示例如下:$→_{条件1}^{试剂1}$产物$→_{条件2}^{试剂2}$产物2…,下列合成步骤可以用完,也可以不用完,不够时也可以自己加.前面合成出来的物质可以作为原料在后面的合成中直接使用(如图).

(6)工业上合成化合物X的一种方法可用如图表示:

已知:
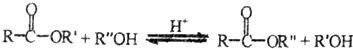
①1mol链状化合物A能与2mol H2发生反应,但A分子中不含有碳碳三键,则A的结构简式是CH2=C=O.
②B分子中含有四元环状结构,则反应I的反应类型是加成反应;反应Ⅱ的化学方程式是
 .
.③与(5)实验室制法比较,本方法的优点是步骤少,原子利用率高.
7.已知葡萄糖的燃烧热△H=-2804kJ/mol,当它氧化生成1g水时放出的热量是( )
| A. | 26.0kJ | B. | 155.8kJ | C. | 51.9kJ | D. | 467.3kJ |
17.下列所涉及的反应不属于置换反应的是( )
| A. | 用铝热反应焊接铁轨 | |
| B. | 镁条在二氧化碳中燃烧 | |
| C. | 用铝和氢氧化钠溶液反应制取氢气 | |
| D. | 用铜和氯化铁溶液反应,制作印刷电路板 |
2.硫酸铁溶液水解可以得到一系列具有净水作用的碱式硫酸铁(xFe2O3•ySO3•zH2O),为测定某碱式硫酸铁的组成,取5.130g样品溶于足量盐酸中,然后加入过量的BaCl2溶液,经过滤、洗涤、干燥得白色固体5.825g,向上述滤液中加入过量的NaOH溶液,经过滤、洗涤、灼烧得到固体1.600g,该样品的化学式为( )
| A. | Fe2O3•2SO3•7H2O | B. | 4Fe2O3•10SO3•25H2O | ||
| C. | 3Fe2O3•6SO3•20H2O | D. | 2Fe2O3•5SO3•17H2O |